
| 操作步骤 | 实验现象 | 结论或化学反应方程式 |
| 取少量样品置于试管中,加入足量稀硫酸,将试管用导管与澄清石灰水相连. | ①产生大量气体,使石灰水变浑浊. ②样品全部溶解,溶液呈蓝色. | ①样品中含有碳酸根离子 ②样品中含有铜离子 |
| 在上述蓝色溶液中,插入一根洁净的铁丝. | ①铁丝表面缓缓产生少量气泡. ②片刻后铁丝表面出现红色物质. | ①Fe+H2SO4═H2↑+FeSO4 ②Fe+CuSO4═Cu+FeSO4 (均用方程式表示) |
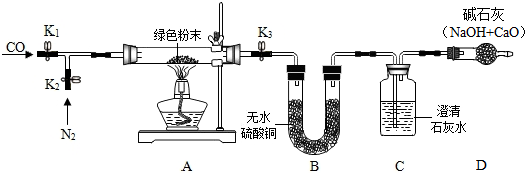
| 装置A | 装置B | 装置C | 装置D | |
| 第一次 加热后 | 绿色粉末变黑色 | 白色粉末变蓝色 质量增加0.9g | 出现白色沉淀, 质量增加2.2g | 无明显变化 质量不改变 |
| 第二次 加热后 | 黑色粉末变红色 质量为6.4g | 无明显变化, 质量不改变 | 沉淀先增加后部分溶解; 质量增加 | 无明显变化 质量不改变 |
分析 此题为物质的推断题,完成此题,可以依据题干提供的信息,样品中加入稀硫酸有能使澄清石灰水变浑浊的气体产生,说明生成了二氧化碳,则样品中含有碳酸根离子,所得溶液与铁接触能生成红色固体,则有铜生成,说明溶液中含有铜离子,铁能与硫酸反应生成硫酸亚铁和氢气,能与硫酸铜反应生成硫酸亚铁和铜,无水硫酸铜遇水会变成蓝色,根据生成水的质量可以求得氢元素和氧元素的质量,根据红色粉末的质量可以求得铜的质量以及与铜结合的氧元素的质量,根据石灰水增加的量可以求得二氧化碳的质量,从而求得碳元素以及其中所含氧元素的质量.
解答 解:实验探究:样品中加入稀硫酸有能使澄清石灰水变浑浊的气体产生,说明生成了二氧化碳,则样品中含有碳酸根离子,所得溶液呈蓝色,说明含有铜离子,与铁接触能生成红色固体,则有铜生成,有气泡产生,则说明还有硫酸,铁能与硫酸反应生成硫酸亚铁和氢气,能与硫酸铜反应生成硫酸亚铁和铜,所以本题答案为:
| 操作步骤 | 实验步骤 | 结论或化学方程式 |
| ①碳酸根(CO32- ) ②铜(Cu2+) | ||
| ①Fe+H2SO4═H2↑+FeSO4 ②Fe+CuSO4═Cu+FeSO4 |
| 装置A | 装置B | 装置C | 装置D | |
| 白色粉末变蓝色 | ||||
点评 本题考查了物质成分的推断,完成此题,可以依据已有的知识结合题干提供的信息进行,要求同学们在平时的学习中加强基础知识的储备,以便灵活应用,另外要熟练的应用质量守恒定律.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
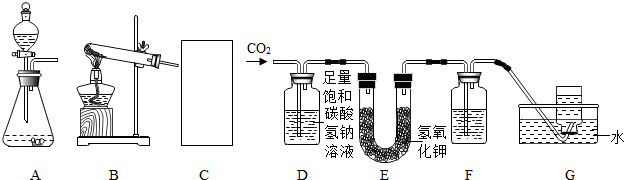
 研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:
研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:| 铁粉质量/g | 0.2 | 0.4 | 0.6 | 0.8 |
| 第一次反应时间/S | 91 | 40 | 45 | 99 |
| 第二次反应时间/S | 84 | 44 | 50 | 82 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
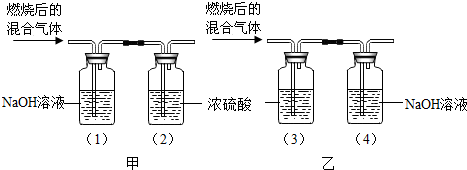
| 燃烧有机物的质量 | 实验装置 | 实验(1)~(4)装置质量 | ||
| 实验前 | 实验后 | |||
| 甲组 | 3.2g | 甲 | (1)150g | (1)154.6g |
| (2)150g | (2)153.4g | |||
| 乙组 | 3.2g | 乙 | (3)150g | (3)153.6g |
| (4)150g | (4)154.4g | |||
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验步骤 | 实验现象 | 结论 |
| ①取样加入足量硝酸溶液 ②取步骤1中反应后的溶液加足量的硝酸钡溶液 ③过滤 ④在滤液中,滴加硝酸银溶液 | 有气泡 有白色沉淀 白色沉淀 | 含有碳酸钠 含有硫酸钠 含有氯化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 | 2:3 | 1:1 | 2:1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com