
| 你观察或 测定的量 | 需要控制 的实验条件 | 选用的 仪器 | 实验步骤 | 结果与推论 |
| | | | | |
| 观察或 测定的量 | 需要控制 的实验条件 | 选用的仪器 | 实验步骤 | 结果 与推论 |
| 测定不同浓度盐酸与足量镁反应所需时间。 | ①需要取相同体 积的盐酸; ②相同的、足量的 镁条; ③在相同的环境 温度下实验。 | 镊子、量筒、 秒表、烧杯、 大试管、 胶头滴管 | ①将镁条剪成相同的 长度。②将镁条加入到 三支大试管中。③分别 量取相同体积的三种 盐酸加入到大试管中。 ④用秒表记录反应所 需时间。 | 如果反应所需时 间最长的,就是 最浓的盐酸,反 之就是最稀的盐 酸。 |


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验方法 | 可能观察到的现象 | 结论 |
| | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液, 充分反应后过滤 | | 有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入 | | 该样品中含有氢氧化钠 |
| 加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | 第七次 |
| 锥形瓶及所盛物质的总质量 | 76.40 | 101.40 | 126.40 | 151.40 | 174.20 | 197.00 | 222.00 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口。 | 发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭。 | 说明罐中重新生成的气体A是________。 |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液。 | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体。 | 说明铝是否与水直接反应:______(填 “是”或“否”),铝能够与_______溶液反应。 |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸。 | 产生了无色无味气体,该气体能使澄清石灰水变浑浊。 | 说明原CO2气体被NaOH溶液吸收。 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
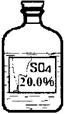
| 物 质 | H2SO4 | Na2SO4 | MgSO4 |
| 常温下的溶解度∕g | 与水以任意比互溶 | 18.0 | 39.0 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com