
【题目】目前,市场上畅销以木糖醇为原料的“口香糖”,对修复蛀牙有所帮助。木糖醇是由碳、氢、氧三种元素组成的,其中氢元素质量分数约为7.89%,氧元素质量分数约为52.6%,且每个分子中含有5个氧原子。请通过计算回答下列问题:
(1)木糖醇的化学式式量为________(四舍五入,取整数,下同)。
(2)一个木糖醇分子中氢原子的个数为________。
(3)该物质的化学式为________。
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对“测定空气中氧气的含量”的实验进行改进,如图,收到了良好的效果。已知,试管体积为100ml,实验前注射器活塞停在30ml处,实验后注射器如图Ⅱ所示。下列说法正确的是( )
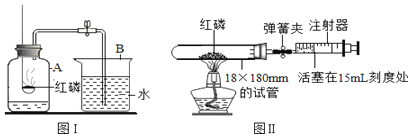
a.图Ⅰ实验中,进入水的体积不到瓶中空气体积的![]() ,可能是由于点燃红磷后,塞回到集气瓶时瓶塞没有塞紧
,可能是由于点燃红磷后,塞回到集气瓶时瓶塞没有塞紧
b.加热时,应先使试管底部均匀受热
c.注射器活塞实验前也可停留在0ml处
d.由实验Ⅱ得出的数据是:氧气占空气体积的15%
e.实验中可以看到注射器活塞先向右,后向左移动
A. abdB. abC. abeD. acd
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国制碱工业先驱——侯德榜先生发明了“侯氏制碱法”,其主要的化学原理如下:![]() ;
;![]()
工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程见图1。
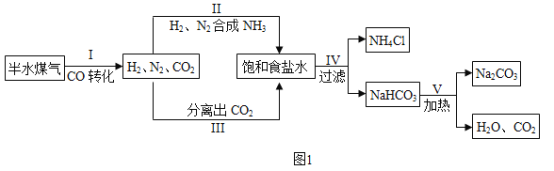
(1)X的化学式为___________,流程中循环利用的物质有H2O和____________。
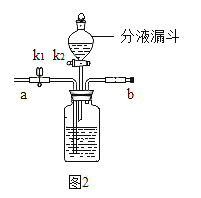
(2)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图2所示。打开k1,关闭k2时,吸收CO2;打开k2,关闭k1时,产生CO2,则广口瓶和分液漏斗中盛放的药品分别是(用化学式表示其溶质)_____________、____________。
(3)将Na2CO3和NaHCO3的混合物10g充分加热,将生成的气体用浓硫酸充分干燥后,再用澄清石灰水除去剩余气体,至固体混合物的质量不再改变时,称得澄清石灰水的装置增重2.2g。则原混合物中Na2CO3的质量分数是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程加下:
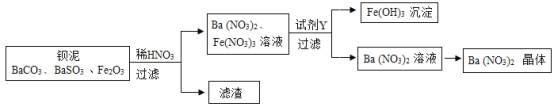
(1) Ba(NO3)2中钡元素的化合价为_____;流程中所涉及的氧化物_______(填1种即可)。
(2) BaCO3与HNO3反应的反应类型是______;写出Fe2O3与HNO3反应的化学方程式:_________
(3)试剂Y为_______(填序号)。
①BaCl2溶液②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是_______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学符号中数字表示的意义正确的是()
A.CO2:“2”表示一个二氧化碳分子含有两个氧原子
B.2Na:“2”表示两个钠元素
C.![]() :“+2”表示镁离子带有两个单位的正电荷
:“+2”表示镁离子带有两个单位的正电荷
D.S2-:“2-”表示硫元素的化合价为-2价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“新冠肺炎”的医疗中会使用大量的溶液,而大部分溶液都可分为酸、碱、盐是初中化学学习的重要内容。
(1)盐酸、硫酸等常见的酸都具有相似的化学性质,是因为它们在水溶液中都解离出___________(填离子符号)。
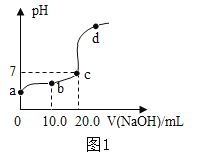
(2)向20.0mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液中的pH随所加氢氧化钠溶液的体积变化如图1所示。下列有关叙述正确的是_________。
A b、d点对应溶液的pH:b>d
B 向b点对应的溶液中滴加石蕊溶液,溶液呈无色
C 所用氢氧化钠溶液的质量分数一定为30%
D d点对应的溶液中溶质是NaCl和NaOH
(3)己知某“84消毒液”瓶体部分标签如图2所示:
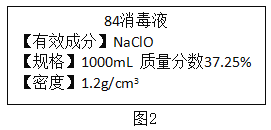
①该瓶“84消毒液”中NaC1O的质量为_________g。
②工业可用氯气和氢氧化钠溶液反应来制取NaClO,同时生成食盐的主要成分和水,写出该反应的化学方程式_____________。
(4)实验室有一瓶长期露置于空气中的氢氧化钠溶液,为确定其成分,小组同学进行了如下探究。
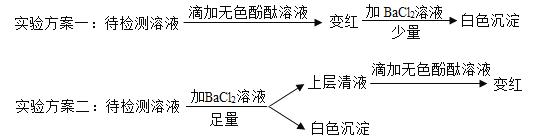
①根据实验方案二确定该瓶溶液的溶质成分是什么_________?
②实验方案一不能准确确定溶质成分,请说明理由_________。
③实验室为防止NaOH溶液变质,可采取什么措施_________?
(5)某造纸厂产生含氢氧化钠的废水需经处理呈中性后再排放。小明取51g该废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,共消耗稀硫酸49g,计算所得溶液溶质质量分数_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(2分)走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:
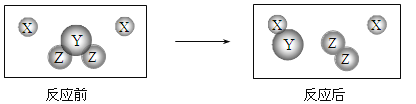
(1)该化学反应中生成物的分子个数比为 ;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是 ;
(3)该化学反应的基本类型为 ;
(4)由X原子构成的物质在该反应中 (填“是”或“不是”)催化剂。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气中氧气含量测定的再认识。
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点有 。
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气集合耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式 。兴趣小组用该方法测出的氧气含量常常远低于21%。
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气; (2) 装置内氧气有剩余;……
【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因 。
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:
。
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氧化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | ||
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 | |
131mL | 90.0mL | 63.6mL | |
请计算出空气中氧气含量 (计算结果保留一位小数)。
【结论与反思】通过上述实验探究,选择 (填物质名称)进行实验,可较为快速地完成实验并减小实验误差。
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由: 。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】蛋白质是构成细胞的基本物质,蛋白质又是由多种氨基酸构成的、复杂的、相对分子质量很大的物质。α—丙氨酸是组成人体蛋白质的丙氨酸之一,下图是α—丙氨酸的分子结构模型图,下列对α—丙氨酸的叙述中,不正确的是( )
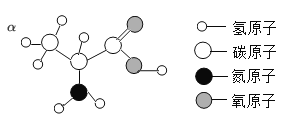
A.α—丙氨酸的化学式为C3H7O2N
B.α—丙氨酸分子中C、O原子个数比为3:2
C.α—丙氨酸中氢的质量分数最大
D.构成该分子的原子中,氢原子最小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com