
����Ŀ�����������������ⶨ������ʶ��
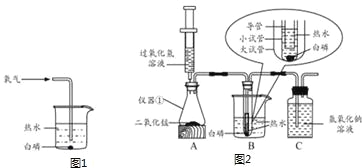
�������������̲��н������������ö����ķ����о��˿����ijɷ֣�ʵ��װ����ͼ1������ʵ����ѡ��ʹ�ù����ŵ��� ��
A��ʵ�������û����Ⱦ
B���ڹ�������Һ������
C�����ɵĻ�������ȷֽ����ܵõ���������
D���ܽ��ܱ�װ���ڿ����е��������Ϻľ�
��ʵ��عˡ�ʵ���ҳ��ú���ȼ�յķ����ⶨ�����������ĺ�����װ����ͼ2����д������ȼ�յĻ�ѧ����ʽ ����ȤС���ø÷��������������������Զ����21%��
��������⡿�ú���ȼ�յķ���Ϊʲô����ȷ�زⶨ�����������ĺ�����
�����в��롿��1��װ��©���� ��2�� װ����������ʣ�ࣻ����
��ʵ���뽻��������ʦ��ָ���£�С���ֱ��ù����ĺ��Ͱ����и�ʵ�飬�ò�����Ũ�ȵĴ�������÷�Ӧ��װ��������Ũ�ȷֱ�Ϊ8.85%��3.21%�����ȼ�������ĽǶȻش���������������Ҫԭ�� ��
��ʵ��̽��1��С�������������ԭ����̽�������ܷ�ȷ�ⶨ�����������ĺ��������ǽ�����ʵ�飨װ����ͼ3��ͨ��7���õ����ݼ�������������ĺ���Ϊ19.13%��
�������뷴˼�����ú���ȼ�յķ�����ȣ�����˿����ķ����ⶨ����Ҫ�ŵ㼰ԭ��
��
��ʵ��̽��2��Ϊ�˼ӿ췴Ӧ���ʣ�С��ͨ���������ϣ��������ۡ�̿�ۡ������Ƶ������ֽ�����ʵ�飨װ����ͼ4����8���Ӻ��õ����������
ʵ��ǰ����� | ʵ�������� | ||
����ƿ�ڿ��� | �ձ�������ˮ | �ձ���ʣ������ˮ | |
131mL | 90.0mL | 63.6mL | |
�������������������� ������������һλС������
�������뷴˼��ͨ������ʵ��̽����ѡ�� �����������ƣ�����ʵ�飬�ɽ�Ϊ���ٵ����ʵ�鲢��Сʵ�������
����չ���졿ͭҲ���������������ˮ��������̼��Ӧ����ʴ������ͭ��[ͭ�̵���Ҫ�ɷ�ΪCu2(OH)2CO3]������ͼ3װ���еĴ���˿����������ͭ˿����ʵ�飬���ж��ܷ�Ƚ�ȷ�زⶨ�����������ĺ�������˵�������� ��

���𰸡�
������������BCD
��ʵ��عˡ�4P+5O2![]() 2P2O5
2P2O5
�����в��롿���ײ���
��ʵ���뽻���������Ż��Ⱥ����Ż���
�������뷴˼��װ���ڲ������������٣�ʵ������ȷ
��ʵ��̽��2��20.2%
�������뷴˼�����ۡ�̿�ۡ������ƺ�����ˮ
����չ���졿���ܣ���Ϊ�����ж�����̼����Լֻ��0.03%��ͭ���ܽ�װ���е����������ľ�
��������
���������
�������������̲��н������������ö����ķ����о��˿����ijɷ֣�ʵ��װ����ͼ1������ʵ����ѡ��ʹ�ù����ŵ����ڹ�������Һ�����ã����ɵĻ�������ȷֽ����ܵõ������������ܽ��ܱ�װ���ڿ����е��������Ϻľ�����ѡBCD��
��ʵ��عˡ��������ڵ�ȼ���������������������ף���Ӧ�Ļ�ѧ����ʽΪ��4P+5O2![]() 2P2O5��
2P2O5��
�����в��롿ʵ������ȡ�ĺ��ײ��㣨��ʵ��ǰû�ме��ɼС�ʵ��װ�ÿ���δ��ȴ�ʹ��ɼеȣ���
��ʵ���뽻����С���ֱ��ù����ĺ��Ͱ����и�ʵ�飬�ò�����Ũ�ȵĴ�������÷�Ӧ��װ��������Ũ�ȷֱ�Ϊ8.85%��3.21%�����ȼ�������ĽǶȻش���������������Ҫԭ������Ż��Ⱥ����Ż��ͣ�
�������뷴˼����˿��ˮ�������������º��������⣬���ú���ȼ�յķ�����ȣ�����˿����ķ����ⶨ����Ҫ�ŵ㼰ԭ��װ���ڲ������������٣�ʵ������ȷ��
��ʵ��̽��2���ձ�������ˮ���ٵ����Ϊ���������=90mL��63.6mL=26.4mL����������������= ![]() 100%��20.2%��
100%��20.2%��
�������뷴˼��ͨ������ʵ��̽����ѡ�����ۡ�̿�ۡ������ƺ�����ˮ��������ʽ���ʵ�飬�ɽ�Ϊ���ٵ����ʵ�鲢��Сʵ�������
����չ���졿ͭҲ���������������ˮ��������̼��Ӧ����ʴ������ͭ��[ͭ�̵���Ҫ�ɷ�ΪCu2��OH��2CO3]������ͼ3װ���еĴ���˿����������ͭ˿����ʵ�飬���ܱȽ�ȷ�زⶨ�����������ĺ�������Ϊ�����ж�����̼����Լֻ��0.03%��ͭ���ܽ�װ���е����������ľ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����ڻ�ѧ�仯����
A��ľ�����ɿ� B������ե��֭ C��������ɾ� D����ѩ����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������ȷ����
A�������ڿ�����ȼ�գ���ɫ����ȼ�գ�����,������ɫ�Ļ���
B��һ����̼��ԭ����ͭ����ɫ������Ϊ�������Ϻ�ɫ
C��������̼ͨ����ɫʯ����Һ�У���Һ����ɫ��Ϊ��ɫ
D����˿�ڿ�����ȼ��,��������,�ų���������,���ɺ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һƿ���ڷ��õ��������ƹ��壨��ͼ1����ij��ȤС��ͬѧ���Ըù�������������̽����
��������⡿��ƿ�������ƹ����Ƿ���ʣ����������Σ�
���������ϡ������������ڿ��������ױ��ʵ�����ת��ΪNaHCO3
��CaCl2��Һ������
��CaCl2+NaHCO3�TCaCO3��+2NaCl
��������롿������������δ����
������������ȫ������
�����������岿�ֱ���
��ԭ����������������ڿ����б��ʵ�ԭ���� ���û�ѧ����ʽ��ʾ����
������ʵ�顿С��ͬѧȡ������Ʒ���ձ��У�������ˮ�ܽ⣬������Һ�е��뼸�η�̪��Һ����Һ��죬�ɴ����ó���������ȷ��������ͬѧ�ܿ����Է���������
��Ϊ�˽�һ���ó����ۣ�����������λͬѧ�ֱ�ȡС��ʵ������Һ���Թ��У��������±���ʾʵ����
ͬѧ | С�� | С�� | С�� |
ʵ����� | ������������������Һ | �����������������Һ | �������ϡ���� |
��ʵ����ۡ�С�졢С����ʵ���ж��۲쵽�а�ɫ������������Һ���Ǻ�ɫ���������Ƕ�����������ȷ��
����˼���ۡ���һ����ʦָ������ƾС���ʵ�������������ȷ����������ȷ��������
��
����������С���Ľ����Ʋ�Сʵ�������� ��
��������⡿��βⶨ���ʵ��������ƹ�����̼���Ƶ�����������
��ʵ��ԭ����ͨ���ⶨһ��������Ʒ������ϡ���ᷴӦ���ɶ�����̼�����������̼���Ƶ�����������
��ʵ����ơ�С���ȡһ����������Ʒ������ͼ2װ�ý���ʵ�飨��֪��װ�����������ã�ˮ�ܸ߶ȿ������µ��ڣ��������Ǵ��п̶ȵ���������
����˼���ۡ���һ����ʵ���У���û��ֲ���ͣ��ⶨ����� ���ƫ����ƫС�����䡱����
�����������У����������Ӱ��ⶨ������� ������ĸ����
A��ʵ��ǰ�Թ����п���
B��ʵ����ˮ�ܿ���ˮ���
C������ʱ�����ܺ�ˮ��Һ�治��ƽ
D��ʵ������ɵ��������Թ�������������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij��ͭ��ͭ��п�Ͻ���ͭ������������ijͬѧȡ20g��ͭ��Ʒ����ʢ��200gϡ������ձ��У�ǡ����ȫ��Ӧ��ͭ��ϡ�����Ӧ��������ձ���ʣ�����ʵ�������Ϊ219.8g���Լ��㣺
��1���������������� g��
��2���û�ͭ��Ʒ��ͭ����������������ϡ���������������������д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016�ꡰ�й�ˮ�ܡ�������������ǡ���ʵ���չ����ƽ����ϸ�ˮ��Դ������������������������һ�������
A������̭�ߺ�ˮ�������� B��ũ������ô�ˮ����
C��������ˮ���д������ŷ� D����ҵ�����ϡ����������������ŷ�.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��̽��������ˮ��ȼ�յ�ʵ��װ������װ�õIJ���֮���У���ͨ������ʱ�������ױ���ɢ�������������Ӵ�������ɢ��������������ɿ�����Ⱦ��ͼ2��̽��������ˮ��ȼ�յĸĽ�ʵ��װ�ã���A��B��C������������������Ķ��������ݲ��ش��й����⣺
���Ͽ���������Ӧ�����κ�ˮ���������Ϊ������������������������������CO2��SO2��SiO2��P2O2����
��1�����������м���1ҩ�������̣���ע��������Լ40mL5%�Ĺ���������Һ��Ȼ��ע��������ͷ������Ƥ������������������Ϊ ��
��2���ڹ��ƿ�м�������������Һ�������ϲ�������˫��������������������Һ��Ŀ���� ��
��3��ȡһר���̶���С�İ�����С�Թ��У��ټ�������Լ80����ˮ����ˮ�ĸ߶���С�Թܸ߶�![]() Ϊ�ˣ��������Թܱ���ҪС����ԭ���� ��
Ϊ�ˣ��������Թܱ���ҪС����ԭ���� ��
��4�������ƶ�ע�������������з�����Ӧ�Ļ�ѧ����ʽΪ ��װ��BС�Թ��й۲쵽������Ϊ���������ݲ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeSO4Ϊԭ���Ʊ���������Fe3O4������Fe����+2�ۣ�Ҳ��+3�ۣ��Ĺ�����ͼ��
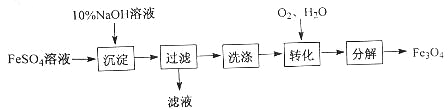
��ת�������̵ķ�ӦΪ��4Fe��OH��2+O2+2H2O�T4Fe��OH��3��
��ԭ���к�FeSO49.12t������˵����ȷ���ǣ� ��
A����������FeSO4��Ӧ��NaOH��Һ������Ϊ4.8t
B�������ϡ�ת�������̲��뷴Ӧ��O2������Ϊ320kg
C���÷������������տ��Ի��Fe3O4������Ϊ4.64t
D������ת�������̲��뷴Ӧ��O2���������������ù��������ƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������
A. ���� B. ���� C. ������̼ D. ϡ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com