
【题目】(10分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
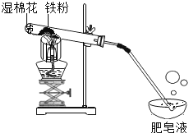
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是_________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
【 拓展 】 把赤铁矿冶炼成铁,其主要反应原理是在高温下,一氧化碳夺取铁矿石里的氧,将铁还原出来,请写出化学反应方程式:______________________________________。
【答案】(1)提供水蒸气;(2)H2;(3)【猜想与假设】猜想二::Fe3O4。
【实验探究】
实验操作 | 实验现象及结论 |
取少量黑色固体于试管中,加入足量的稀盐酸 | 若固体全部溶解,没有气泡冒出,剩余固体是Fe3O4.若固体全部溶解,有气泡冒出,剩余固体是Fe与Fe3O4. |
【实验结论】3Fe+4H2O 高温 Fe3O4+4H2↑【反思与交流】Fe2O3是红棕色粉末
【 拓展 】Fe2O3 + 3CO 高温 2Fe + 3CO2
【解析】
试题分析:试管尾部放一团湿棉花的目的是提供水蒸气;用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是H2;试管中剩余固体为黑色,能全部被磁铁吸引。所以【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是Fe3O4,因为氧化亚铁不能被磁铁吸附;可以根据看看混合物中是否含有铁来确定是哪种猜想正确,加入酸看是否有气泡,如果有说明是猜想一正确。铁和水蒸气反应的化学方程式为3Fe+4H2O 高温 Fe3O4+4H2↑;该黑色固体不可能是Fe2O3,理由是Fe2O3是红棕色粉末;把赤铁矿冶炼成铁,其主要反应原理是在高温下,一氧化碳夺取铁矿石里的氧,将铁还原出来,化学反应方程式为Fe2O3 + 3CO 高温 2Fe + 3CO2


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源: 题型:
【题目】微粒观是化学基本观念的重要组成部分,从微粒视角认识物质世界是学习化学的重要方法.以下描述正确的是( )
A.原子是最小的粒子,不可再分
B.自然界中一切物质都是由分子构成的
C.元素的种类是由原子核内的质子数决定的
D.原子最外层电子数的多少决定了原子质量的大小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿石(主要含Fe2O3)、空气等,主要反应过程如下:
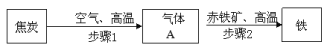
请回答:
(1)步骤1所涉及的化学反应方程式为__ ______ _。
(2)步骤2的化学方程式 。
(3)某钢铁厂每天需消耗5000t含Fe2O3 80%的赤铁矿,该厂理论上可日产含铁98%的生铁的质量是_________t(结果保留整数)。
(4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,无气泡产生,则滤渣中一定不含有_______(填化学式),滤液中一定含有的溶质是______(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是 。
A.青铜 B.铝 C.钢 D.生铁
(2)每年因腐蚀而报废掉的金属材料数量惊人,铁生锈的条件是铁与 和 同时接触。
(3)工业炼铁可以把赤铁矿(主要成分为Fe2O3)在高炉里和CO反应,生成单质铁,
该反应的化学方程式是 ;
①氧化铁(Fe2O3)的相对分子质量是 ;
②2000t含氧化铁80%的赤铁矿中理论上可炼得含铁90%的生铁 t(保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)配制一定溶质质量分数的氯化钠溶液常有以下操作。
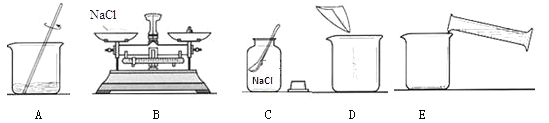
请回答下列问题:
(1)用上图所示的序号表示配制该溶液的正确操作顺序为 。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节游码 D.添加砝码
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。
(4)下列过程中对所配制溶液的溶质质量分数没有影响的是( )
A.配制时所用烧杯中有少量水
B.称量时有少量氯化钠残留在纸上
C.将量筒中的水转移到烧杯时,有少量水溅出
D.搅拌均匀后,转移到试剂瓶时有少量溶液溅出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)下图中的六个圆A、B、C、D、E、F分别表示六种物质,蓝色溶液A与C反应能生成两种沉淀,B为氧化物,C、D、E、F分别是碳酸钠溶液、稀硫酸、氢氧化钡溶液和氢氧化钠溶液中的一种,E中溶质可用于生产洗涤剂。用“→”表示一种物质能转化为另一种物质,用两圆相切或“——”表示两种物质可以发生化学反应,六种物质之间的部分反应及转化关系如右图所示。请利用初中化学知识回答下列问题:
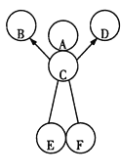
(1)写出以下物质(或溶质)的化学式;(3分)
B________ E_______F________
(2)写出C与A反应的化学方程式为 __________________
(3)写出C→D的化学方程式_________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某胃药标签上的部分内容,兴趣小组欲测定该药品中碳酸氢 钠(NaHCO3)的质量分数,取10片该药品研碎放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水也不参加反应),共消耗稀盐酸23g,测得反应后烧杯内物质的总质量为25.8g。请计算:

(1)10片药品的质量为 g,反应共生成气体的质量为 g;
(2)药品中碳酸氢钠的质量分数.
(3)反应后所得溶液中溶质的质量分数.(计算结果保留到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)镁及其化合物在生产、生活中应用广泛。
(1)从海水中提取金属镁,可按下图流程进行:

①下列说法正确的是 (填字母)。
A.步骤Ⅰ通过一步反应即可实现
B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能
D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是 。
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究。
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3yMg(OH)2zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物。
【设计实验】该小组同学设计了下图所示的实验装置,假设每步反应和吸收均进行完全。

【进行实验】取23.3g碱式碳酸镁晶体进行实验,步骤如下:
①连接好装置并检查气密性。
②装入药品,打开活塞K,通入一段时间空气。
③分别称量装置C、D的质量(数据见下表)。
装置C的质量 | 装置D的质量 | |
步骤③ | 292.4g | 198.2g |
步骤⑥ | 296.9g | 207.0g |
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解。
⑤停止加热,同时打开活塞K,通入空气至恢复到室温。
⑥再次分别称量装置C、D的质量(数据见右表)。
【实验分析】
①装置A的作用为 ,装置D的作用为 。
②反应后,装置B中的剩余固体是 ,质量为 g。
③该碱式碳酸镁晶体[xMgCO3yMg(OH)2zH2O]中,x︰y︰z = (写最简整数比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com