
【题目】如图是甲、乙两种固体物质的溶解度曲线.
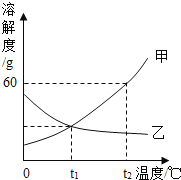
(1)溶解度随温度升高而减小的物质是________.
(2)t1℃时,甲、乙两种物质的溶解度______.
(3)要使乙的饱和溶液变为不饱和溶液,除加水之外还可采用的方法是_______.
(4)要使甲从其饱和溶液中析出,可用________的方法.
(5)t2℃时,甲的饱和溶液中溶质的质量分数是_________.
科目:初中化学 来源: 题型:
【题目】常见的锅有陶瓷锅、铁锅、铜锅等。
(1)与陶瓷锅相比,用铜锅加热更快,利用的金属性质是_______。
(2)铁锅清洗后如未擦干,容易产生红色铁锈,该过程中发生了_____(填“物理”或“化学”)变化。
(3)铜锅加热后,锅底容易产生一层黑色的氧化铜,反应的化学方程式为________。
(4)用钢丝球清洗铜锅时,用力过大容易在铜锅上产生划痕。说明钢的硬度比铜___(填“大”或“小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入a克Zn粉,充分反应后过滤,将洗涤、干燥后称量,得到的固体质量为a克。据此,下列说法正确的是( )
A. 滤液中的物质一定至少有两种
B. 取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
C. 取滤渣滴加稀盐酸,一定有气泡产生
D. 取反应后的滤液观察,滤液一定呈无色
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】了解物质的组成和结构,有助于认识物质的性质和变化。
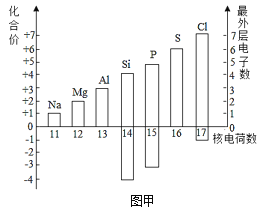
(1)图甲表示核电荷数为11~17的元素最高和最低化合价和原子的最外层电子数。
①若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为_____。硫元素既可显正价,又可显负价,硫元素与钠元素形成的化合物由_____(填“分子”、“原子”或“离子”)构成,其化学式为_____。
②铝原子失去最外层电子所形成的离子符号为_____。
③写出图中元素的化合价与最外层电子数有关的一条规律_____。
(2)将NaOH、KCl、MgCl2三种溶液按一定比例混合,微观变化情况如图乙。
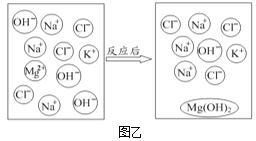
①图中OH-的名称是_____。
②该反应的本质是_____结合生成沉淀。
③写出与上述反应本质相同的另一反应的化学方程式:_____(反应物之一为MgCl2)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如下图所示。下列说法不正确的是
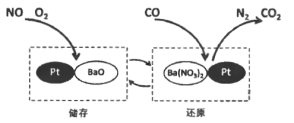
A. 降低NOx排放可以减少空气中酸雨的形成
B. 储存时,吸收NOx (如NO, NO2)的物质是BaO
C. 还原时,发生的反应是: ![]()
D. 若有28 g CO参与反应,则生成CO2的质量为22g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
(1)实验一:恒温条件下,向100mL一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
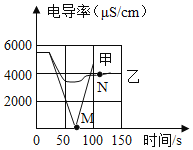
①甲曲线M点时混合液体呈_____色;
②通过对甲曲线的分析,下列说法错误的是_____(填序号).
a.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
b.M点时离子浓度几乎为零
c.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
③经测定,M点时消耗稀H2SO4溶液50mL,且过滤后滤液质量为147. 67g。请计算原Ba(OH)2溶液的溶质质量分数_____ (写出计算过程,各种稀溶液的密度都可看成1g·mL-1)。
(2)实验二:恒温条件下,向100mL同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是_____(填序号).
a.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
b.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
c.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是______________(填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度_____(填“增大”或“减小”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验中经常用到一定溶质质量分数的溶液,请回答:
(1)小明在实验室配置质量分数为12%的碳酸钠溶液。
①计算:配制100g该碳酸钠溶液需要碳酸钠固体的质量为_________g。
②称量:用托盘天平称量所需的碳酸钠,放入烧杯中,小明在称取时发现托盘天平的指针偏向右盘,正确的做法是_________(填序号)。
a 增加砝码 b减少砝码 c添加固体 d减少固体 e调节平衡螺母向右旋
③量取:用量筒量取水(水的密度是1g/mL)的体积时仰视读取液体体积,读数比实际量取液体体积________________(填偏大、偏小或不变)
④溶解:用玻璃棒搅拌,使碳酸钠溶解。
⑤将配制好的溶液装入试剂瓶,盖好瓶塞,贴上标签,请帮小明完成如图标签内容。_______

(2)小刚要把(1)配得的溶液稀释为6%,需要加水的质量为___________g。
(3)稀硫酸常作为工业上的除锈剂,现配制4.9%的稀硫酸2000g,需要98%的浓硫酸(密度为1.84g/mL)___________mL(计算结果精确至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A﹣G是初中化学中常见的物质,其相互反应及转化关系如图所示,部分反应条件省略.已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体.
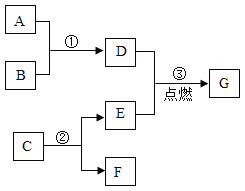
(1)G的化学式为____________。
(2)写出相应反应的化学方程式:
①____________。②____________。
(3)反应③的实验现象是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com