
����Ŀ�������Ǹ������Դ���⣬���ú�ˮ����ȡ�������Ʒ��
��1���ú�ˮ��ʳ�Σ���ͨ���õ����Σ������к���������CaCl2��Na2S04�����ʣ���ȥ�������ʣ��ȼӹ���BaCl2��Һ��ȥ �� �ټ���Һ��ȥCaCl2������BaCl2 �� ���ɵij�������ȥ��
��2���Ӻ�ˮ����ȡ�峣�ô�����������������C12������ˮ���廯�ƣ�NaBr���е����û����������ÿ�����ˮ���������壨Br2��������ʾ��ͼ���£� 
��д�������û����嵥�ʵĻ�ѧ����ʽ�����÷�Ӧ��pH=3�����������½��У������ⶨ��ӦҺ�����ȣ�
�ڴ�������ʹ������������һ��������������������з����ķ�Ӧ��Br2+SO2+2H2O�TH2SO4+2HBr������������ͼ������ͨ��SO2��Ŀ���� ��
���𰸡�
��1��������ˮ��Na2S04��Na2C03������
��2��Cl2+2NaBr=2NaCl+Br2��pH��ֽ�������������
���������⣺��1����ˮɹ�ε�ԭ����ͨ��������ˮ�Ƶô��Σ�����BaCl2���Ժ������Ʒ�Ӧ�������ᱵ�������Ȼ��ƣ��Լ�̼���ƿ��Ժ�CaCl2��Ӧ�����Ȼ��ƺ�̼��Ƴ�������ˮ�����ʣ�ͬʱ�������ɵ����ʾ��dz������Ȼ��ƣ����Թ��˺���Һ��ֻ���������Ȼ��ƣ���2���������������֪�������廯�ƿ����û����嵥�ʣ��仯ѧ��ѧ����ʽΪ��Cl2+2NaBr�T2NaCl+Br2 �� �����IJⶨ��Һ���ȵķ�����ʹ��pH��ֽ�ⶨ��Һ�����ȣ������������з����ķ�Ӧ��Br2+SO2+2H2O�TH2SO4+2HBr���Լ�����������Ŀ����ʹ�����������룻 ���Դ��ǣ���1��������ˮ��Na2SO4��Na2CO3�����ˣ� ��2����Cl2+2NaBr�T2NaCl+Br2��pH��ֽ �ڷ������������
�����㾫�����������⣬������Ҫ�˽���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ(ע�⣺a����ƽ b������ c������)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ҵ���̣���ʯ��CaC2�� ![]() �ҽ�
�ҽ� ![]() ���� ���е�ʯ��ˮ�ķ�ӦΪ��CaC2+2H2O=Ca��OH��2+C2H2��
���� ���е�ʯ��ˮ�ķ�ӦΪ��CaC2+2H2O=Ca��OH��2+C2H2��
��1����������Ҫ�ɷ���Ca��OH��2�� �� ��ҵ��������Ȳ��C2H2�������Ļҽ��Ͳ����Ʊ�����ԭ��KClO3�ͳ�ϸCaCO3 ��
��2�����Ʊ�KClO3���������£� 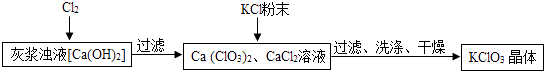
��ҽ���Һ��ͨ��Cl2 �� �õ�Ca��ClO3��2��CaCl2��Һ����Ӧ��Ca��ClO3��2��CaCl2�Ļ�ѧ�������ֱ�Ϊ1��5��д���˷�Ӧ�Ļ�ѧ����ʽ ��
��3���й������ڳ����µ��ܽ�����£�
���� | Ca��ClO3��2 | CalO3 | KClO3 | KCl |
�ܽ��/g | 209.0 | 74.5 | 7.3 | 34.2 |
���������м���KCl��ĩ��KCl�����ѧʽ�������˸��ֽⷴӦ���õ�KClO3���壮����Ϊ�ܵõ�KClO3�����ԭ���� ��
��4��ϴ��ʱ����ѡ������ϴ�Ӽ�������ĸ��ţ��� A��KCl������Һ B����ˮ C������KClO3��Һ
��5�����Ʊ���ϸCaCO3���������£�ע������NH4Cl��Ŀ�����ܽ�����е������Σ��� 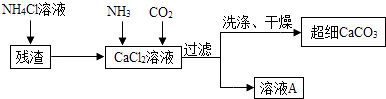
��CaCl2��Һ��ͨ���������壬���ɳ�ϸCaCO3�Ļ�ѧ����ʽ ��
��6����������ҺA��ѭ��ʹ�ã�����Ҫ�ɷֵĻ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���һ�ܱյ������з���ij��Ӧ����÷�Ӧ�����и����ʵ��������±���ʾ��
���� | X | Y | Z | Q |
��һ�β�õ�����/g | 32 | 51 | ©�� | 6 |
�ڶ��β�õ�����/g | 60 | 17 | 11 | 12 |
�����ж���ȷ���ǣ� ��
A.�÷�Ӧ��X��Q�������仯֮��Ϊ5��1
B.�÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ��Y��X+Z+Q
C.Z�����Ǹ÷�Ӧ�Ĵ���
D.�÷�Ӧ�������û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������۵Ĺ�������ȿ�����ƣ�����ƹ����е�����ø��������ת��Ϊ�����ǣ������Ƿ���Ϊ�ƾ�������ľ���������ø�ԭ�����þ���ø���׳ƾ�ҩ�������ģ���ͥһ����������ļ�����ͼ��ͼ����ע���л���Ӧ��ѧ����ʽ���ü��ű�ʾ�� ![]()
��1����ƽ��ѧ����ʽ����C6H10O5��n�����ۣ�+H2O ![]() nC6H12O6�������ǣ�
nC6H12O6�������ǣ�
��2�����¶ȡ�ˮ�ֵ����ؿ��Ʋ��������������������ζƫ�ᣬ����ɸ÷�Ӧ�Ļ�ѧ����ʽ��C6H12O6 ![]() 2�����ᣩ��
2�����ᣩ��
��3������ľ������ʱ��Խ����ζԽŨ����Ϊ������������ھƻ�ø�����·��ͷֽ�Ϊ�ƾ���C2H5OH ���Ͷ�����̼��д���÷�Ӧ�Ļ�ѧ����ʽ ��
��4������1kg�������ƣ�����������0.81kg�ĵ���ȫ��ת��Ϊ�ƾ����������Ͽ����ƺ��ƾ���������Ϊ10%����kg������ʾ���ɵ���ת��Ϊ�ƾ��Ĺ�ϵʽΪ��C6H10O5��n��2nC2H5OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���������ù������⡢����ء�������ض�������ȡ��������ԭ����
A�������������� B������������ C���������������� D����������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�е�A��I��ʾ���ֳ��л�ѧ�����Ĵ�����ҷֱ�����H��C��O��S��Cl��Na��Ca�е����ֻ���������Ԫ����ɣ�����A��E��H�������A����Ԫ����������Ϊ60%��I�׳�С�մ�C��I�ֱ�������F��Ӧ����������ͬ��ͼ�С�������ʾ���˵����ʼ��ܷ�����ѧ��Ӧ����������ʾ���ʼ����ת����ϵ�����ַ�Ӧ�������������ȥ�� 
��1��д��I�Ļ�ѧʽ��E�Ļ�ѧʽ ��
��2����C���ʵ�ˮ��Һ�еμ���ɫ��̪��Һ����̪��Һ��ɫ��
��3��д��A��B��Ӧ�Ļ�ѧ����ʽ ��
��4��д��G�����ֽⷴӦ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���᳧��ˮ�к����������ᣬΪ����ŷţ�����ԱС�ŶԷ�ˮ������ĺ������м�⣮
��1��������Һ�� ������������������Ϊ4%��NaOH��Һ100g����ҪNaOH����g��ˮml��ˮ���ܶ�Ϊ1g/cm3����
��2���������� ȡ��ˮ��Ʒ98g����������μ���NaOH��Һ��ǡ����ȫ��Ӧʱ������4%��NaOH��Һ20g���������ˮ�������ɷ־�����NaOH��Ӧ��������Ӧ�Ļ�ѧ����ʽΪ��2NaOH+H2SO4�TNa2SO4+2H2O��
�Լ����ˮ�����������������д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���������������о���
��1����ͼ�������ٵ�����Ϊ �� ������Ӧ�Ļ�ѧ����ʽΪ �� ��װ��Ҳ������ʵ���������壨��дһ�֣�����ѧ����ʽΪ �� 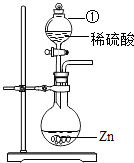
��2����֪��ͬ�¶��£��������������Խ����Һ������Խǿ��������18%��ϡ�����pH2%��ϡ���ᣨ���������������=����������ϡ����������²�������Һ��pH��ѧ�仯�����ߵ���������ĸ���� A��������ˮ B������������ C���������������� D��������Ũ����
��3���������ձ��зֱ�ע��Ũ���ᣨ������������Ϊ98%���ܶ�Ϊ1.84g/m3����ϡ���ᣨŨ������ˮ�������1��1����10ml����������¼��ͬʱ�䣨h������������Һ��ˮ��������g�����ݼ��±���
ʱ��/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
��ˮ����/g | Ũ���� | 1.6 | 2.2 | 6.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
ϡ���� | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
�������Ϊ1��1ϡ������������������������ʽΪ �� ����ȡŨ����ʱ���Ӷ�����������ϡ����������������������ƫ����ƫС�����䡱��
���ɱ���ʵ�����ݿ�֪��
a���й�������ˮ�Ե�˵������ȷ����������ĸ����
A��Ũ��ϡ���ᶼ����ˮ�� B��ֻ��Ũ��������ˮ�� C��Ũ������ˮ�Խ�ϡ����ǿ
b��ʵ���ұ���ϡ����ʱҪ��ţ��ڸ��������Ӧѡ����������������Ũ����ϡ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com