
【题目】根据下表回答问题:
温度(℃) | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 100℃ | |
溶解度 (g/100g 水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 246 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 39.8 | |
① 20℃时,50 克水中最多能溶解 NaCl______ g。
② 将硝酸钾的不饱和溶液转化为饱和溶液的方法________。(任写一种方法)若硝酸钾溶液中混有少量氯化钠,可通过______的方法提纯。
③ 硝酸钾和氯化钠溶解度相同的温度范围为______。(填编号)
I. 0℃-10℃ II. 10℃-20℃ III. 20℃-30℃ IV. 30℃-40℃
④ 30℃时,在两个各盛有 100 克水的烧杯中,分别加入相同质量的硝酸钾和氯化钠,充分溶解后,其结果如图所示。

I. 两烧杯中的溶质质量分数大小关系为 A________ B。(填“>”“<”或“=”)
II. 加入的甲物质是________。
III. 对 B 中乙溶液的分析,正确的是______。
a. 加水,溶质质量分数一定变小
b. 一定是该温度下的不饱和溶液
c. 溶解的固体质量一定大于 36.3g,小于 45.8g d. 降温至 10℃,一定有晶体析出
【答案】 18 加硝酸钾(或蒸发水或降温) 降温结晶(或冷却热饱和溶液) III < NaCl a、d
【解析】① 20℃时,氯化钠的溶解度为36g,50 克水中最多能溶解 NaCl18g;
②由于硝酸钾的溶解度随温度的升高而增大。所以欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是降低温度(或增加硝酸钾或蒸发水);由于硝酸钾的溶解度受温度影响比较大,氯化钠的溶解度受温度影响较小,所以硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是降温结晶(或冷却热饱和溶液);
③从表中数据分析,硝酸钾和氯化钠溶解度相同的温度范围是20℃~30℃;
④I. 由于甲物质没有完全溶解,水的质量相同,所以两烧杯中的溶质质量分数大小关系为 A<B;
II. 30℃时,硝酸钾的溶解度是45.8g,氯化钠是36.3g,所以别加入相同质量的氯化钠和硝酸钾,充分溶解后,加入的甲物质是氯化钠;
III.a、对 B 中乙溶液加水,溶质的质量不变,溶剂的质量增加,溶质质量分数一定变小,正确;b、对 B 中乙溶液,溶质已完全溶解,无法判断溶液是否饱和,错误;c、30℃时,在两个各盛有 100 克水的烧杯中,分别加入相同质量的硝酸钾和氯化钠,充分溶解后,因为氯化钠有不溶解的,所以所加入的质量一定大于36.3g,但硝酸钾全部溶解,一定小于或等于45.8g,错误;d、由于加入的物质一定大于36.3g,一定小于或等于45.8g,降温至 10℃时,硝酸钾溶解度为20.9g,一定有晶体析出,正确。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:初中化学 来源: 题型:
【题目】下列是某兴趣小组制取二氧化碳,收集并检验该气体的有关实验操作,其中错误的是
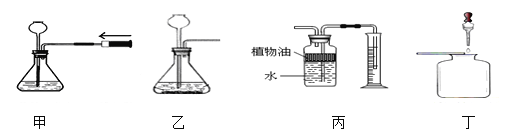
A. 甲图中推动注射器时,长颈漏斗下端液面上升,说明气密性良好
B. 乙图中长颈漏斗下端要伸入液面下,是为了防止气体逸出
C. 丙图装置中植物油的作用是为了防止二氧化碳气体溶于水
D. 丁图中为了检验二氧化碳气体,滴入的试剂为氢氧化钠溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO47H2O),其工艺流程如下:

查阅资料:SiO2不溶于水,也不与稀硫酸反应。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+H2O、_____。
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有_____(写1条,不考虑“搅拌”和“使用催化剂”)。
(3)“过滤”操作需要使用的玻璃仪器有烧杯、玻璃棒和_____,“过滤”后得到的滤液中的溶质有_____(填化学式)。
(4)“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2 (SO4)3+2Y═2FeSO4+2H2SO4,则Y的化学式是_____。
②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3═3FeSO4.测得“还原”后溶液的pH明显增大,其原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,把江水净化成自来水,需要以下净化步骤:
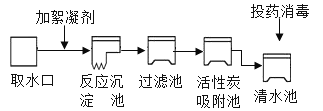
请回答下列问题:
(1)活性炭在净水中起________作用,经过以上步骤最后得到的水__________(填“是”或“不是”)纯净物。实验室中,通过________________可制得净化程度较高的水。
(2)取少量江水于小烧杯中,加入肥皂水并搅拌,发现肥皂泡很少且有大量浮渣。说明江水是_________(填“硬水”或“软水”)。
(3)①三聚磷酸钠(化学式为Na5P3O10)是含磷洗衣粉成分之一。该物质会造成水体富营养化。三聚磷酸钠中磷元素的化合价是_________。②为了防止水体受到污染,下列做法正确的是_____(填字母序号)。
a.生活污水集中处理后排放 b.农业上禁止化肥、农药的使用
c.工业生产中的废水处理达标后排放
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食品与健康、能源与环境是我们共同关注的社会问题。
(1)紫薯营养丰富,具有特殊的保健功能。紫薯中富含淀粉、维生素C、维生素B、铁、钙、硒等。
①这里的“铁”、“钙”是指_____________(填字母);
A.原子 B.分子 C.元素 D.单质
②人体缺“铁”,会导致_____________病症;
③紫薯中能给人体提供能量的物质是_____________;
④硒元素被誉为“抗癌大王”。硒元素的部分信息如图。下列说法正确的是____(填字母)。
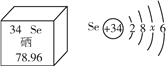
A.硒属于金属元素
B.一个硒原子中有34个质子
C.硒的原子结构示意图中x =18
D.硒元素的相对原子质量为78.96 g
(2)天然气是汽车使用的燃料之一,其主要成分燃烧反应的化学方程式是_____________。
(3)二氧化碳是造成温室效应的主要气体,从“低碳”的角度分析,应尽量减少二氧化碳的排放。将排放出的二氧化碳吸收并转化为可再利用的物质是科学家研究的方向。检验吸收后的气体中是否含有二氧化碳,依据反应的化学方程式是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室里,某同学看到氢氧化钠试剂瓶的瓶口有白色粉末,他对白色粉末的成分作出了一些猜测。
猜测一:可能是氧氧化钠 猜测二:可能是碳酸钠 猜测三:可能是氧氧化钠和碳酸钠
为探究白色粉末的成分,他将该粉末溶于水,得到无色溶液,再迸行了如下实验:
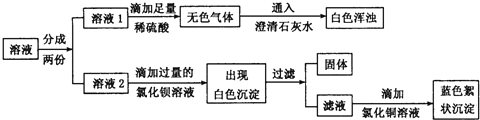
(1)根据实验现象推测,无色气体是________。
(2)在溶液2中滴加过量氯化钡溶液的目的是____________________
(3)由实验现象可知,猜测___是正确的,写出产生蓝色絮状沉淀的化学方程式__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】燃烧与我们的生活与社会的发展有着密切的联系.
(1)如图是燃烧条件示意图:
请根据初中所学知识,写出燃烧的三个条件:
①________
②________
③________
(2)物质发生化学反应的同时,伴随着能量的变化,通常表现为________变化.人类通过化学反应获得的能量,大多来自于化石燃料.石油是化石燃料之一,它属于________(填“纯净物”或“混合物”).
(3)奥林匹克火炬(内部储有可燃物)是奥林匹克圣火的载体.
①采集奥林匹克圣火的唯一方式,是在奥林匹克的赫拉神庙前通过太阳光集中在凹面镜的中央,引燃圣火.此过程中最关键的燃烧条件是________.
②北京奥运会火炬能在每小时65公里的强风和每小时50毫米雨量的情况下保持燃烧.但要实现奥运圣火登顶珠峰,还需要解决最关键的燃烧条件是________.

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取氧气,提供了下列药品和常用装置,请按要求回答有关问题:
药品:①过氧化氢溶液 ②氯酸钾 ③二氧化锰
装置:
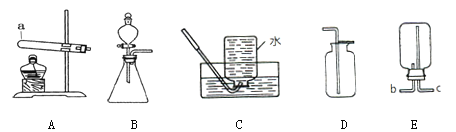
(1)装置中仪器a的名称为 。
(2)若小明选择装置A和C来制取氧气,则他选择的药品应为 (填序号);
若用装置D收集氧气,则验满的操作方法为将带火星的木条伸到 ,观察木条是否复燃。
(3)某气体X可用D装置收集,若改用E装置收集,则气体X应从 口进(填“b”或“c”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1 g二氧化锰混合,总质量为6 g,依次加热该混合物,t1、t2、t3、t4时间后分别冷却,称量剩余固体质量,记录的有关数据如下表(样品中杂质不参加化学反应)。
(1)完全反应后产生氧气的总质量为________________。
(2)样品中氯酸钾的纯度是多少___________?
加热时间 | t1 | t2 | t3 | t4 |
剩余固体(g) | 4.24 | 4.16 | 4.08 | 4.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com