
【题目】I、用所学化学知识填空。
(1)下列材料不属于合金的是____(填“陶瓷”或“硬铝”)。
(2)改良酸性土壤可以用____(填“烧碱”或“消石灰”);
(3)打开瓶塞,在空气中能产生“白雾”的是____(填“浓硫酸”或“浓盐酸”);
(4)用井水洗衣服时,肥皂不易起泡沫且产生浮渣,该井水是____(填“硬水”或“软水”)。
II、请完善网络图,并根据图示关系回答下列问题:
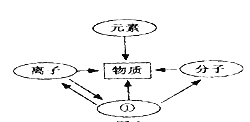
(1)物质是由 __________组成的;
(2)构成物质的微粒有分子、离子和 ______________;
(3)分子是由 ________________构成的;
(4)原子得到电子转化为________________(填“阳离子”或“阴离子”)。
【答案】 陶瓷 石灰 浓盐酸 硬水 元素 原子 原子 阴离子
【解析】根据所学知识知,I、(1)不属于合金的是陶瓷,硬铝属于铝合金。(2)改良酸性土壤可以用消石灰,价格便宜。(3)打开瓶塞,在空气中能产生“白雾”的是浓盐酸,浓盐酸具有挥发性,易形成白雾。(4)用井水洗衣服时,肥皂不易起泡沫且产生浮渣,该井水是硬水,硬水泡沫少。II、根据所学知识和题中信息知,(1)物质是由元素组成的,元素属于宏观概念;(2)构成物质的微粒有分子、离子和原子,分子、离子和原子都是构成物质的一种微粒;(3)分子是由原子构成的;(4)原子得到电子转化为阴离子,核内质子数小于核外电子数。
点睛∶改良酸性土壤常用消石灰。肥皂水遇硬水,泡沫少,遇软水,泡沫多。分子、离子和原子都是构成物质的一种微粒。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:初中化学 来源: 题型:
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一.高纯CaO的制备
【资料一】
Ⅰ.无水硫酸铜遇水变成蓝色的硫酸铜晶体。
Ⅱ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅲ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去。
甲同学用如下装置制备CaO并验证石膏与焦炭高温反应的其他产物。

实验过程中发现:B中无水硫酸铜变蓝,C中产生_____________现象证明有SO2生成,装置_____中无明显变化和装置F中_____________现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:___________________。
二.硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如下:

【资料二】氧化钙与焦炭在高温下反应生成碳化钙和一氧化碳。
(1)反应①的化学方程式为__________________________。证明固体M中不含CaCO3的方法是____________________________(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4 + 2KCl ═ K2SO4↓+ 2NH4Cl,该反应能析出K2SO4晶体的原因是_____________________________________。
(3)假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。
【资料三】碳化钙在空气中灼烧生成氧化钙和二氧化碳气体。
步骤一:称取3.76g样品于下图所示石英管中(测定装置图如下,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)

步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
①装置甲的作用是_______。反应完全后继续缓缓通入空气的目的是_________。
②根据步骤一、二计算该样品中钙、碳、氧的质量比为______________,计算确定CaCx的化学式(请写出计算过程)________。
③应用:丙同学经查阅资料知道实验室常用电石(主要成分为碳化钙)与水反应制取乙炔气体(发生装置如图)。经实验发现,电石与水反应非常剧烈,为控制反应的速度以得到平稳的气流,下列改进方法可行的是______。
A.改长颈漏斗为分液漏斗或注射器 B.将电石研成粉末
C.将锥形瓶置于冰水浴中 D.用饱和食盐水代替水(电石与氯化钠不反应)

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学晚会上,小明表演了一个小魔术——“矿泉水”变成“牛奶”、“雪碧”和“红酒”。回答下列问题:
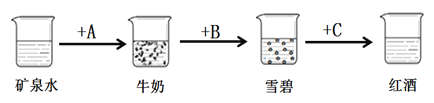
(1) “矿泉水”实际是石灰水,加入液体A后出现白色浑浊,形似牛奶,该过程发生反应的化学方程式为__________。
(2)“牛奶”中加入B,有大量气泡产生,变成雪碧,则B物质是________,该过程发生的化学反应最多有________个。
(3)C是一种紫色的溶液,滴入“雪碧”中变为红色,则雪碧的组成是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型多功能水处理剂。下图为制取(K2FeO4)的流程,请根据图示回答下列问题:

(1)固体B中含有的物质是_______________________;
(2)操作I的名称是_________,玻璃棒在操作中的作用是____________;
(3)请写出反应①的化学方程式________;反应②属于______反应(填基本反应类型);
(4)写出溶液C中溶质的一种用途_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某垃圾处理厂对生活垃圾进行综合处理时制备FeSO47H2O的流程如下:

资料1: 垃级焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
资料3:FeSO47H2O的溶解度随温度的升高增幅较大。
回答下列问题:
(1)下雨时,将烟气直接排放到空气中会形成_______________________。
(2)溶解步骤中发生的三个化学反应是:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;Fe + H2SO4 =FeSO4 + H2↑;Fe+Fe2(SO4)3=3FeSO4 。
①反应Fe+Fe2(SO4)3=3FeSO4的反应类型是_______________________。
②溶解时能观察到的现象有固体溶解、溶液颜色改变和_____________________________。
③根据反应Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O,如果生锈铁制品中含有160Kg的Fe2O3,理论上能生成Fe2(SO4)3的质量是__________________。
(3) 后续处理包括①将所得FeSO4溶液在氮气环境中蒸发溶剂浓缩、冷却结晶、过滤得到FeSO47H2O晶体;②用少量冰水洗涤2﹣3次滤出的FeSO47H2O晶体。其中氮气的作用是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示(mol·L-1是浓度的一种表示方法)。下列说法正确的是
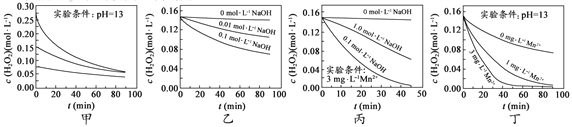
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越大,H2O2分解速率越快
C. 图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丁表明,碱性溶液中,Mn2+浓度越大,H2O2分解速率越快
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是物质A、B的溶解度曲线,下列说法正确的是

A. 两种物质的溶解度都随温度的升高而增大
B. t2℃时,将溶液A、B降温至t1℃都有晶体析出
C. t1℃时,溶液A、B的溶质质量分数一定相等
D. t2℃时,所配溶液A的溶质质量分数不超过28.6%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其他杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取11.4g样品放在烧杯中并滴入稀盐酸。当盐酸滴至73g时,烧杯内溶液的总质量为80g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示。(纵坐标表示生成气体质量)试计算
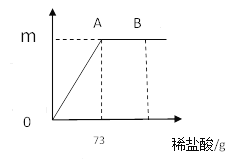
(1)反应到A点时产生的气体质量m=________________________。
(2)求A点时,烧杯内溶液中溶质的质量分数_________。(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明取酸性锌锰干电池进行探究,他发现电池内部结构如图1所示。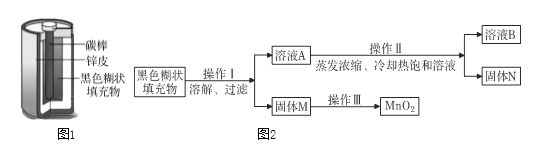
【查阅资料】(1)锌皮为金属锌(含有少量的铁)
(2)黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl等组成
(3)有关数据见下表
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
【实验探究一】小明取适量黑色糊状填充物,按图2所示实验流程进行探究。
(1)溶液A中溶质主要有______(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是____________。
(2)欲从固体M 中得到较纯的MnO2,操作Ⅲ可采用的简便方法是____________。
【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
① 实验中可观察到的现象是_________;
② 下列各组物质混合后,也能生成ZnCl2的有_________(填字母序号)。
A.ZnO与稀盐酸 B.ZnSO4溶液与BaC12溶液
C.ZnCO3与NaCl溶液 D.Zn(NO3)2溶液与NH4Cl溶液
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F。当溶液E中只含一种溶质时,该溶质是________(填化学式);当固体F中只含一种物质时,溶液E中最少含有________种溶质。
③若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量________0.2g(选填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com