
【题目】以金红石(主要成分是TiO2)为原料生产金属钛的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体;②在稀有气体环境和加热条件下,用Mg与TiCl4反应得到Ti和MgCl2;下列说法不正确的是( )
A.①中的反应为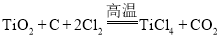
B.反应②中稀有气体的作用是隔绝空气
C.反应①②中钛元素的化合价均发生改变
D.反应②中金属的总质量保持不变
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】如图所示,A~H是初中化学常见的物质。A和B可发生中和反应,X常用作食品干燥剂,Y为单质。根据图示回答下列问题:

(1)B的俗称为 。
(2)H的化学式为 。G必定含有的金属离子是 。(填符号)
(3)反应②的化学方程式为 。
(4)反应③的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体(Ca10(PO4)6(OH)2)形式存在,其相对分子质量为1004,牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。如图是某品牌纯牛奶包装上的部分文字说明,请认真阅读后回答下列问题:

(1)牛奶中富含的营养素为 (填一种即可)。
(2)Ca10(PO4)6(OH)2由 种元素组成。
(3)一盒牛奶含钙至少多少g?(精确到0.01)
(4)若人体每天至少需要0.6g钙,而这些钙有90%来自牛奶,则一个人每天要喝多少盒牛奶?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是实验室制取气体的常用装置。请回答下列问题。
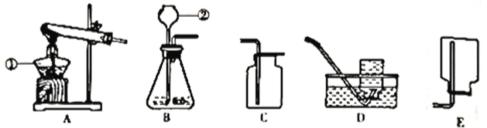
(1)A装置中仪器①的名称是______试管口略向下 倾斜的原因是___________ 。
(2)仪器②的名称是___ 该仪器的主要 作用是______________ 。
(3)实验室用加热氧酸钾制取氧气,应选择的发生装置为_______(填字母序号);若要收集较纯净的氧气,应选择的收集装置是_________ ( 填字每序号)。写出过氧化氢溶液和二氧化锰的混合物制取氧气的化学方程式___________________________ 。
(4)制取氧气和二氧化碳均可选择的发生装置和收集装置为_____________ ( 填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上冶炼金属锌主要有火法和湿法两种工艺。
(1)火法炼锌时发生如下反应:
2ZnS+3O2 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2 2CO;ZnO+CO
2CO;ZnO+CO Zn+CO2。
Zn+CO2。
①化合物ZnS中Zn元素的化合价是_____,上述反应在鼓风炉中控制温度在1100℃至1300℃进行,使生成的锌气化蒸馏出来,蒸馏过程属于_____变化。
②已知反应前矿石中ZnS的质量为ag,则理论上可以生成Zn的质量为_____g(用含a的式子表示,可不化简)。
(2)湿法炼锌的原理是利用CO32-与Zn2+结合生成ZnCO3沉淀。某研究小组利用该原理,用碳酸钠作为沉淀剂,探究从含锌废水中回收锌的最佳条件,实验的数据如下:
实验编号 | 初步处理的废液用量/mL | pH值 | 反应时间/min | 沉锌率% |
a | 800 | 6 | 30 | 84.30 |
b | 800 | 7.5 | 10 | 85.27 |
c | 800 | 7.5 | 30 | 99.60 |
d | 800 | 8.0 | 30 | 99.55 |
①本实验探究了哪些因素对沉锌率的影响_____。
②已知碳酸钠溶液呈碱性。实验中碳酸钠使用量最大的是_____(填编号)。工业生产中采用实验_____(填编号)的提取条件更合理。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料广泛应用于生产生活中。
(1)下列金属制品中,利用金属导热性的是__(填字母)。
A 金属硬币 B 铝制导线 C 铜制火锅
(2)将纯铝和铝合金相互刻画,纯铝上留下了明显的划痕,说明____。
(3)有X、Y、Z三种金属,只有Z常温下能与氧气反应。若把X、Y分别放入稀硫酸中,Y表面出现大量气泡而X表面无明显变化,则以下反应定不能发生的是__(填字母)。
A ![]()
B ![]()
C ![]()
D ![]()
(4)钢铁易生锈。汽车在喷漆前可用盐酸“酸洗”,以除去钢铁表面的铁锈,此反应的化学方程式为__。
(5)铝热剂是修建铁路时常用的焊接材料,其反应原理是在高温下,铝与四氧化三铁反应得到熔融的铁与一种氧化物,该反应的化学方程式为_____。
(6)向硝酸铜、硝酸银和硝酸镁的混合溶液中加入一定质量的金属锌,充分反应后过滤,得到滤渣和滤液。以下推断不正确的是___。
A 若滤液为蓝色,则滤渣中一定有银,可能有铜
B 若向滤液中加入稀盐酸无白色沉淀生成,则滤液中一定有硝酸镁、硝酸锌
C 若向滤渣中加入稀盐酸有气泡生成,则滤液中只含有硝酸镁和硝酸锌
D 若反应前加入的金属锌的质量和反应后滤渣的质量相等,则滤渣中一定不含锌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是( )
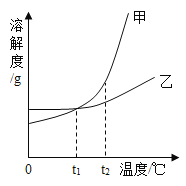
A.甲、乙的溶解度相等
B.要从含有少量乙的甲溶液中得到较多的甲,通常可采用蒸发结晶的方法
C.等质量的甲、乙分别配成t2℃时的饱和溶液,需要水的质量:甲小于乙
D.t1℃时,甲、乙的饱和溶液升温到t2℃后,溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
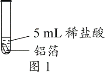
【题目】化学小组同学用图1装置探究铝与盐酸的反应。将未去除表面氧化膜的铝箔放入稀盐酸中,刚开始反应现象不明显,一段时间后反应比较剧烈,产生大量气泡,出现灰色沉淀。
(查阅资料)
①铝粉在颗粒较小时为灰黑色;铝既能与酸反应,又能与碱反应,且反应均生成氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
③氧化铝与盐酸反应的化学方程式为:![]() 。
。
(实验一)探究灰色固体的成分
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
实验操作 |
|
|
|
|
实验现象 | 有微量气泡产生,固体溶解 | 有少量气泡产生,固体溶解 | ____________ | 固体部分溶解 |
(实验二)探究盐酸浓度对灰色固体产生量的影响
取0.09 g铝箔和5 mL不同浓度的稀盐酸,用图1装置进行实验。
实验序号 | 盐酸浓度 | 实验现象 |
2-1 | 4.0% | 刚开始反应现象不明显,一段时间后缓慢反应,然后反应比较剧烈,有大量气泡产生,出现灰色沉淀 |
2-2 | 2.8% | 先是看不到反应现象,一段时间后缓慢反应,然后慢慢地反应比较剧烈,有大量气泡产生,出现少量灰色沉淀 |
2-3 | 2.1% | 3~4小时后明显有气泡产生,反应慢慢地比较快些,试管底部出现少量灰色沉淀 |
2-4 | 1.4% | 反应更慢,出现极少量的灰色沉淀 |
(解释与结论)
(1)铝与盐酸反应的化学方程式为___________。
(2)图1所示实验中,刚开始反应现象不明显,一段时间后才看到有气泡产生的原因是________。
(3)由实验________(填实验序号)可以判断灰色固体中含有铝。
(4)由实验1-4可知,灰色固体中还含有氯化铝。实验1-3的现象是_________。
(5)实验二的结论是__________。
(反思与交流)
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,可以将稀盐酸换成______进行图1所示实验。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
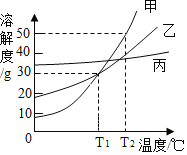
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com