
【题目】(一)铁的广泛应用
(1)“加铁酱油”中的铁指的是______ (填字母).
A 单质
B 元素
C 原子
(2)铁制炊具加热食物,说明铁具有的性质是_____ .
(二)草酸亚铁晶体组成的测定
草酸亚铁晶体(化学组成为FeC2O4·xH2O)是一种淡黄色晶体粉末.
(查阅资料)(1)CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉;
(2)FeO和Fe3O4都是黑色物质,FeO在空气中不稳定,易被氧化.草酸亚铁晶体受热分解生成四种氧化物,为确定分解产物及x的值,设计如下实验。
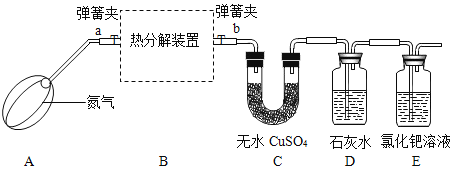
(实验设计)(装置C、D、E中药品均足量)
(小贴士)白色的无水CuSO4吸收水分后变蓝色
(实验步骤)
(1)连接装置,检查________;
(2)称装置C的质量;
(3)在装置B中装入9.0g的草酸亚铁晶体,打开弹簧夹a、b,鼓入一定量氮气;
(4)用酒精灯加热B装置,直至晶体完全变成黑色,停止加热;
(5)继续通氮气至装置冷却,关闭弹簧夹a、b;
(6)再次称量装置B中固体质量、装置C的质量.
(进行实验)该小组同学按上述实验步骤进行实验,并记录了如下数据:
装置B中固体质量(/g) | 装置C的质量(/g) | |
实验前 | 9.0 | 168.2 |
实验后 | 3.6 | 170.0 |
(实验分析及数据处理)
(1)加热前先鼓入一段时间氮气的目的是_______;
(2)实验过程中,装置C中固体变为蓝色,说明草酸亚铁晶体分解生成了_____FeC2O4·xH2O中x的值为___;实验结束后若不继续通氮气,X值将____(填“偏大”、“不变”或“偏小”);
(3)装置D中石灰水变浑浊,说明草酸亚铁晶体分解还生成了_____;
(4)装置E出现黑色物质,说明草酸亚铁晶体分解还生成了_____;同时装置E还具有的作用是吸收___,防止污染大气;
(5)根据上表数据,计算反应后装置B中残留黑色物质的化学式_____;
(6)实验后,装置B中固体的颜色由淡黄色变成黑色,写出草酸亚铁晶体受热分解的化学方程式______;
【答案】B 导热性 气密性 排尽装置内空气,(防爆炸或排尽装置内空气,防止FeO被氧化等) H2O 2 偏小 CO2 CO CO FeO ![]()
【解析】
(一)(1)“加铁酱油”中的“铁”等不是以单质、分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关,故选B;
(2)铁制炊具加热食物,说明铁具有的性质是导热性;
(二)[实验步骤](1)连接装置,检查装置的气密性;
[实验分析及数据处理](1)由下面的分析可知,![]() ,一氧化碳具有可燃性,混有一定量的空气,容易发生爆炸,且FeO在空气中不稳定,易被氧化,所以加热前先鼓入一段时间氮气的目的是:排尽装置内空气(或防止发生爆炸、防止FeO被氧化等);
,一氧化碳具有可燃性,混有一定量的空气,容易发生爆炸,且FeO在空气中不稳定,易被氧化,所以加热前先鼓入一段时间氮气的目的是:排尽装置内空气(或防止发生爆炸、防止FeO被氧化等);
(2)无水硫酸铜遇水变蓝色,装置C中固体变为蓝色,说明草酸亚铁晶体分解生成了H2O;
结合实验中装置C中的无水硫酸铜变蓝色,装置C增加的质量既是草酸亚铁中水的质量为分解后生成水的质量:170.0g-168.2g=1.8g,9.0g草酸亚铁晶体中FeC2O4的质量为9.0g-1.8g=7.2g,即(56+12×2+16×4):18x=7.2:1.8,x=2;
实验结束后若不继续通氮气,装置中的剩余的部分水蒸气不能被C装置吸收,使x值偏小;
(3)二氧化碳能和澄清石灰水反应生成白色沉淀碳酸钙,所以装置D中石灰水变浑浊,说明草酸亚铁晶体分解生成了二氧化碳;
(4)一氧化碳能与氯化钯溶液反应生成黑色的物质,所以装置E出现黑色物质,说明草酸亚铁晶体分解生成了一氧化碳;氯化钯溶液能吸收一氧化碳,防止大气污染;
(5)分解后生成水的质量为170.0g-168.2g=1.8g,则草酸亚铁晶体中FeC2O4的质量为9.0g-1.8g=7.2g,则其中Fe元素质量为:7.2g×![]() ×100%=2.8g,又因为加热分解装置中剩余黑色固体质量为3.6g,所以剩余物中氧元素质量为3.6g-2.8g=0.8g,设此黑色物质的化学式为FeaOb,则
×100%=2.8g,又因为加热分解装置中剩余黑色固体质量为3.6g,所以剩余物中氧元素质量为3.6g-2.8g=0.8g,设此黑色物质的化学式为FeaOb,则![]() ,解得:a:b=1:1,所以热解装置中残留黑色物质的化学式为FeO;
,解得:a:b=1:1,所以热解装置中残留黑色物质的化学式为FeO;
(6)由分析可知,草酸亚铁晶体受热分解可以生成四种氧化物:FeO、CO2、CO、H2O,故化学方程式为:![]() 。
。


 寒假学与练系列答案
寒假学与练系列答案科目:初中化学 来源: 题型:
【题目】 “天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:

①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24 %的樟脑的酒精溶液
下列说法中,不正确的是
A.溶液中的溶质可以为多种
B.樟脑的酒精溶液中酒精是溶剂
C.溶质质量分数为24 %的含义是指每100 g的溶剂中,溶质是24 g
D.“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是_____________(选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
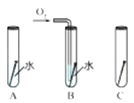
(2)铁钉生锈,属于_____变化(选填“物理”“化学”):右图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是______(选填字母)。
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为_____________。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C![]() 4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
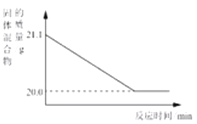
①由图可知:生成CO2气体的质量为_____g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是
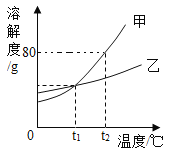
A.甲中含有少量乙时,可直接用过滤法提纯甲
B.t2℃时,将50g甲加入50g水中,可得到90g溶液
C.t1 ℃时,甲、乙的溶液中所含溶质质量相等
D.t1 ℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数甲=乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图甲、乙分别为钠元素、溴元素在元素周期表的信息,A、B、C、D为四种粒子的结构示意图,请你回答:
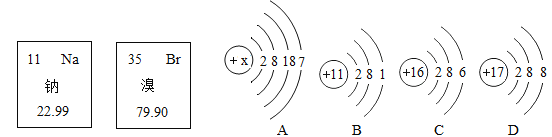
(1)若图A表示的是一种原子结构示意图,x的数值为_____。
(2)溴元素的相对原子质量_____。
(3)B、C、D中与溴元素化学性质相似的为_____。
(4)写出A、B两种原子形成化合物的化学式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组为探究中和反应做了如下实验,根据实验回答下列问题:
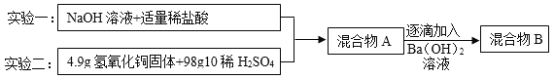
(1)写出实验一发生反应的化学方程式_____;
(2)通过计算判断,实验二中溶液的溶质成分是_____;
(3)向混合物A中滴加Ba(OH)2溶液,滴加过程中生成沉淀质量的曲线如图象所示,结合图象,下列说法中,正确的是_____。
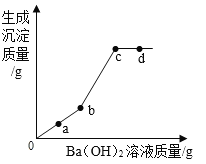
A 取a点溶液加入Mg,一定会产生气泡
B 可用b点溶液一次性鉴别NaOH溶液和Na2SO4溶液
C 可用c点沉淀除去CuSO4溶液中的H2SO4
D只用d点溶液可检验NaCl溶液中是否含有Na2SO4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)城市中的生活用水是经自来水厂净化处理过的。有时可利用____________ (填物质名称)溶于水后生成的胶状物对杂质的吸附,使杂质沉降来达到净水的目的。
(2)水是常见的溶剂,A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示。
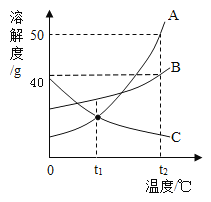
①t2℃时,A 的饱和溶液中溶质的质量分数为 ____________ (保留一位小数)
②下列说法正确的是(__________)
A. t2℃时,A、B、C 三种物质的溶解度大小为:A>B>C
B.将 t2℃时 A、B、C 的饱和溶液分別降温至 t1℃,所得溶液中溶质的质量分数大小为:B>A=C
C.从含有少量 B的 A的饱和溶液中得到较多的 A 晶体,通常可采用冷却热饱和溶液的方法
(3)压强为 101 kPa 和温度为 0℃时,氮气在水中的溶解度为 0.024,这句话的含义是______ 。
(4)下图实线方框内是化学反应的类型,相邻虚线方框内是对应的一个有水参加的反应的 化学方程式,请在图中填空。
化合反应 | H2O+CO2=H2CO3 |
分解反应 | ____________ |
置换反应 | Fe+4H2O |
其它 | 6H2O+6CO2 |
(5)初中化学中,我们学习了稀盐酸和氢氧化钠溶液(如图所示)发生中和反应的实质是:H++OH= H2O,像这种用实际参加 反应的离子符号来表示反应的式子叫离子方程式。以稀盐酸和氢氧 化钠溶液反应为例,离子方程式的书写一般按以下步骤:
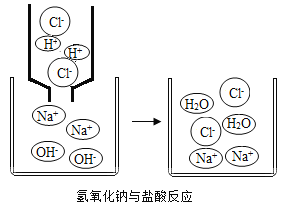
Ⅰ.写出稀盐酸与氢氧化钠溶液反应的化学方程式____________。
Ⅱ.把易溶于水且易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。 上述方程式可改写成:H++Cl++Na++OH- = Na++Cl-+H2O;
Ⅲ.删去方程式两边不参加反应的离子,继续改写成:H++OH=H2O;
Ⅳ.检查方程式两边各元素的原子个数和电荷总数是否相等。则稀盐酸和氢氧化钠溶液反应的离子方程式为: H++OH- = H2O。请回答:
(6)写出稀盐酸和碳酸钙发生反应的离子方程式____________;
(7)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离 子的反应,生成物中有____________生成时,复分解反应才可以发生。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
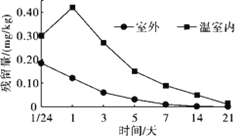
农药在农业生产中发挥着至关重要的作用,可以有效地防控农作物病虫害。但某些地区确实出现过农药残留超标事件,让一些人“谈药色变”。怎样科学地减少果蔬中的农药残留呢?有些农药随着温度的升高,分解会加快。通过在沸水中焯或使用蒸、炒等烹饪手段可以去除蔬菜中氨基甲酸酯类农药的残留。部分农药在空气中能够缓慢地分解为对人体无害的物质。所以对一些易于保存的农产品,如胡萝卜、南瓜、土豆等,可以在室外存放一定时间来减少农药残留量。有科研人员监测了番茄中三唑酮(C14H16ClN3O2)在温室大棚内和室外的分解规律,如图。
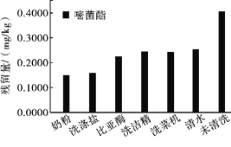
去皮可以有效减少果蔬中的农药残留。但部分果蔬不容易去皮,如生菜、草莓、樱桃等,因此清洗成为了消费者去除农药残留的重要方式。由于大多数农药难溶于水,可利用洗菜机或加入洗涤盐等方式提高农药残留的去除效果,有人研究了利用不同方法去除黄瓜中嘧菌酯农药残留的效果,如图所示。
可见,减少农药残留的关键是认识物质的性质。基于农药的不同性质,采用有针对性的方法来去除。
依据文章内容回答下列问题。
(1)在沸水中焯蔬菜可以去除氨基甲酸酯类杀虫剂的残留,这是利用了氨基甲酸酯类的_______(填“物理”或“化学”)性质。
(2)三唑酮C14H16ClN3O2由_______种元素组成。
(3)依据图,影响番茄中三唑酮残留量的因素有________。
(4)为了最大量地去除黄瓜中的嘧菌酯,在清洗黄瓜时,应采用的方法是________。
(5)下列说法合理的是_________(填字母序号)。
A.为了防止农药在农产品中残留,必须全面禁止使用农药
B.采摘瓜果后,建议清洗干净再食用
C.削去果皮,也能减少农药残留
D.利用农药的某些物理和化学性质可以有效地减少农药残留量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com