
 如图,一辆载满电石的货车在雨中行驶时突然燃起大火,并伴有大量黑烟.某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动.
如图,一辆载满电石的货车在雨中行驶时突然燃起大火,并伴有大量黑烟.某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动.分析 【猜想假设】根据质量守恒定律反应前后元素的种类不变及氧气不具有可燃性、氧化钙遇到水会产生氢氧化钙进行分析;
【实验探究】根据信息结合实验的现象分析产物的成分;
根据碳酸钙和氢氧化钙的性质分析实验;
【反思交流】根据现象分析能量的变化.
解答 解:【猜想假设】(1)反应物中含有Ca、C、O、H四种元素,根据质量守恒定律反应前后元素的种类不变,所以推测气体可能是氧气、氢气或乙炔(C2H2);
(2)但由于氧气不具有可燃性,所以不可能是氧气;因为氧化钙遇到水会产生氢氧化钙,所以白色固体不可能是氧化钙;
【实验探究】步骤1点燃可燃性气体之前需要验纯,所以上述操作中有一处错误是:点燃气体之前没有进行验纯;
(2)因为结论电石与水反应产生的固体是氢氧化钙而不是碳酸钙,氢氧化钙的溶液呈现碱性,能够使酚酞试液变成红色或取滤渣加稀盐酸无气泡产生,排除碳酸钙,证明是氢氧化钙;
【反思交流】①运输中做好电石的防火工作就可以避免上述事故的发生,故正确;
②因为碳化钙易和水反应,因此碳化钙应贮存在阴凉干燥的库房,故正确;
③根据反应产生乙炔的质量可以计算碳化钙的质量,从而计算电石中碳化钙的含量,故正确;
④二氧化碳密度比空气大,易溶于水,乙炔,密度比空气小,难溶于水,收集方法不同,故错误.
故选:①②③.
故答案为:【猜想假设】(1)化学反应前后,元素种类不变;
(2)气体不可能是氧气,因为氧气不具有可燃性;白色固体不可能是氧化钙,因为氧化钙与水反应生成氢氧化钙;
【实验探究】步骤1:点燃气体之前没有进行验纯;
步骤2:加水溶解,过滤取上层清液滴加无色酚酞溶液,溶液变红;
取滤渣加稀盐酸无气泡产生;
【反思交流】①②③.
点评 本题属于信息题的考查,可以依据题目提供的信息结合相关的知识进行分析得出结论,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
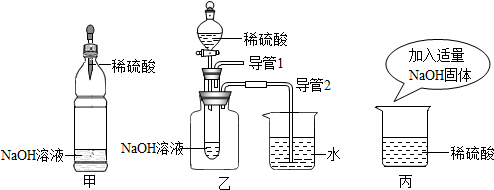
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
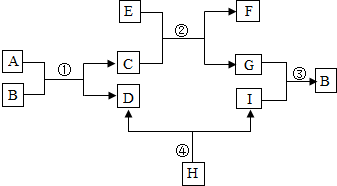
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 元素中期表中含有大量的化学知识点和信息,根据如图能直接得到的信息说法不正确的是( )
元素中期表中含有大量的化学知识点和信息,根据如图能直接得到的信息说法不正确的是( )| A. | 钠原子最外层有11个电子 | B. | 钠的相对原子质量是22.99 | ||
| C. | 钠属于金属元素 | D. | 钠的原子序数为11 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定有CaCO3、Na2SO4,一定无CuSO4、BaCl2 | |
| B. | 一定有CaCO3、Na2SO4,一定无CuSO4 | |
| C. | 一定有CaCO3,一定无CuSO4、BaCl2 | |
| D. | 一定有CaCO3,一定无CuSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
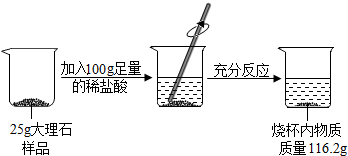
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 晶体中结晶水质量分数 |
| 12.0g | 22.0g | 18.2g | 38% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
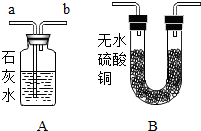 某学习小组发现,铜绿[Cu2(OH)2CO3]受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体.于是他们就通过实验探究分析黑色固体的组成,并验证产生的气体.请你参与一起分析探讨:
某学习小组发现,铜绿[Cu2(OH)2CO3]受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体.于是他们就通过实验探究分析黑色固体的组成,并验证产生的气体.请你参与一起分析探讨:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com