
【题目】人类社会的发展离不开常见金属和金属材料,用我们学到的化学知识和方法能分析和解释许多现象。
(1)下列生活用品,主要利用金属具有良好导热性的是________________。
A  B
B  C
C  D
D 
(2)常见的三种金属被发现、使用的先后顺序依次为铜、铁、铝。金属大规模被使用的先后顺序跟下列____(填序号)关系最大。
①地壳中金属元素的含量
②金属的导电性
③金属活动性
(3)工业上用赤铁矿(主要成分为氧化铁)炼铁的化学反应方程式为_____________________;世界上每年有近四分之一的钢铁被锈蚀,为了保护金属资源我们必须学会防锈,下列介绍的实例只利用隔绝氧气来达到防锈的是______________________________________________。
A  B
B ![]() C
C  D
D 
(4)工业生产中,切割铁板时用硫酸铜溶液在铁板上画线可留下红色的印迹。有关反应的化学方程式为________________________________________。
(5)铁粉常用作双吸剂,将一包部分变质的双吸剂放入过量稀盐酸中,充分反应后所得溶液中的溶质可能是________________(友情提示:在溶液中可发生Fe+2FeCl3===3FeCl2反应)
【答案】A ③ ![]() C Fe+CuSO4===Cu+FeSO4 HCl、FeCl2或HCl、FeCl2、FeCl3
C Fe+CuSO4===Cu+FeSO4 HCl、FeCl2或HCl、FeCl2、FeCl3
【解析】
(1)铸铁炊具主要利用金属具有良好导热性,故填:A。
(2)金属的活动性越强,越难冶炼,大规模被使用越晚,所以金属大规模被使用的先后顺序跟金属活动性有关,故填:③。
(3)一氧化碳还原氧化铁生成铁和二氧化碳,化学反应式是Fe2O3+3CO![]() 2Fe+3CO2;防锈一般要隔绝氧气和水,但夏天停暖后暖气片内注满水防止内部生锈,只是隔绝氧气防锈,故填:Fe2O3+3CO
2Fe+3CO2;防锈一般要隔绝氧气和水,但夏天停暖后暖气片内注满水防止内部生锈,只是隔绝氧气防锈,故填:Fe2O3+3CO![]() 2Fe+3CO2 C。
2Fe+3CO2 C。
(4)铁可还原硫酸铜生成红色的铜,留下红色的印迹,化学方程式是Fe+CuSO4=Cu+FeSO4,故填:Fe+CuSO4=Cu+FeSO4。
(5)双吸剂变质即有部分铁生锈,投入过量盐酸中,发生的反应为Fe+2HCl=FeCl2+H2↑、Fe2O3+6HCl=2FeCl3+3H2O、在溶液中可发生的Fe+2FeCl3=3FeCl2反应;根据反应的可能情况,溶液中一定有氯化亚铁及剩余的盐酸,氯化铁可能存在,故填:HCl、FeCl2或HCl、FeCl2、FeCl3。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:
【题目】请根据图回答问题:
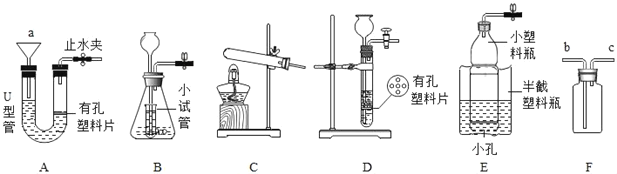
(1)仪器a的名称是__;图中可用于加热高锰酸钾制备氧气的装置为__(填序号),化学反应方程式为__。
(2)实验室若用A装置中制备二氧化碳气体,其化学反应方程式为___。若在反应进行中将A装置的橡胶管中部用止水夹夹住,可能出现的现象是___。
(3)检验装置D气密性的方法是:用止水夹夹紧导管口的橡胶管后,___,则气密性良好。
(4)若用过氧化氢溶液制备O2,最好选用装置__(填序号),其化学反应方程式为__。把F装满水,用排水法收集O2并测定气体体积,O2导入端应在__端(填“b”或“c”),在另一端则需要连接上一个__(填仪器名称)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氧原子结构示意图和硫元素在元素周期表中的信息。下列说法正确的是( )
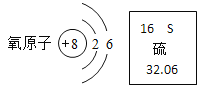
A. 氧原子核外有6个电子
B. 硫、氧均属于非金属元素
C. 硫原子的相对原子质量为32.06g
D. 硫、氧两种元素在元素周期表中都位于第六周期
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】构建知识网络能帮助我们理解知识间的内在联系,请分析如图知识网络,回答有关问题。(连线表示相互反应)
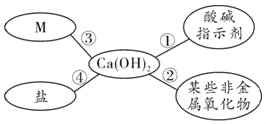
(1)小红将无色酚酞试液滴加到Ca(OH)2溶液中,溶液呈_____色。
(2)氢氧化钙可由生石灰与水反应制得,该反应的化学方程式为_____。
(3)图中M所属的物质类别是_____。
(4)由性质②可知Ca(OH)2溶液暴露在空气中会变质,必须密封保存,其反应的化学方程式为:_____。
(5)为了验证性质④,可选择的物质是_____(填序号)。
A Na2CO3 B HCl C KCl D CuSO4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像不能正确反映其对应变化关系的是( )
A. 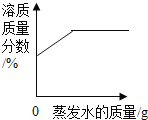 某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
B.  一定质量的红磷在密闭容器中燃烧
一定质量的红磷在密闭容器中燃烧
C.  将一瓶浓硫酸露置于空气中
将一瓶浓硫酸露置于空气中
D. 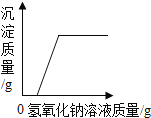 向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:
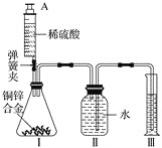
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
【答案】(1)![]() ;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
【解析】
试题(1)由于铜排在了氢的后面,所以与酸不反应,反应物是锌和硫酸,生成物是硫酸锌和氢气,氢气后面标上上升符号;实验过程中须加入稀硫酸至不再产生气体,目的是使样品中的锌完全反应;(2)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到带有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(3)根据加入稀硫酸的量进行计算需要知道稀硫酸的溶质质量分数,而题中没有告知;(4)由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根据热涨冷缩的原理可知进入量筒中水偏多,所以误认为得到的氢气多,再就是数据处理时,未排除加入稀硫酸所占的体积,计算的结果就偏大;
考点:金属的化学性质;化学方程式;实验误差分析;
点评:熟记金属活动性顺序表,知道排在氢之前的金属和稀盐酸或者硫酸反应生成氢气,而排中氢之后的金属和稀盐酸或者稀硫酸不生成氢气;化学反应中物质的质量比都是纯净物之间的质量比,而溶液中溶质的质量=溶液质量×溶质质量分数;本题容易出错的地方是对实验结果的评价,要知道锌与硫酸反应放出热量,会造成相应的误差,必须冷却到室温才能进行观察和计算。
【题型】实验题
【结束】
30
【题目】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种物质的溶解度曲线。下列叙述错误的是

A. t1℃时,三种物质的溶解度大小顺序为A<B<C
B. t2℃时,A、B两种物质的溶解度相等
C. t3℃时B的饱和溶液降温到t1℃,变成不饱和溶液
D. 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一次化学实验课上,老师让同学们对两个实验进行探究。
实验一:探究氢氧化钠溶液中是哪一种粒子能使无色酚酞溶液变色
[猜想]可能是水分子、钠离子或氢氧根离子使无色酚酞溶液变色。
[实验]
(1)在第一支试管中加入约2 mL蒸馏水,滴入几滴无色酚酞溶液。现象:溶液不变色;
(2)在第二支试管中加入约2 mL氯化钠溶液,滴入几滴无色酚酞溶液。现象:____;
(3)在第三支试管中加入约2 mL氢氧化钠溶液,滴入几滴无色酚酞溶液。现象:________。
[结论]____。
实验二:用注射器向充满某种气体的软塑料瓶中注入一种液体(如图),振荡,发现塑料瓶变瘪,探究气体和液体可能是什么物质?

[猜想]气体和液体可能是_____(写一组即可)。
[实验]用试管取少量实验后塑料瓶中的溶液,加入试剂___,产生相应的现象,其化学方程式为____。
[评价]上述实验完成后,能否验证你的猜想_____,理由是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】模型是联系宏观与微观的桥梁。下图是氢分子和氧分子运动的示意图。下列说法不正确的是
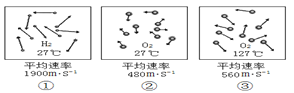
A. 由①②③可知微粒之间有空隙
B. 由①②③可知微粒在不停地运动
C. 由①②可知微粒的运动速度与物质本身性质有关
D. 由①③可知微粒的运动速度与温度有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com