
【题目】如图中甲-戊是初中化学教材中常见物质。甲、戊为氧化物且甲为黑色固体,乙、丙分别是酸和碱中的一种,丁是大理石的主要成分(图“—”表示相连的物质间可发生反应,“→”表示一种物质可转化为另一种物质,反应条件、部分反应物与生成物均已略去)下列说法中正确的是
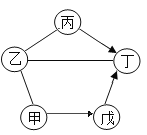
A.乙溶液能使无色酚酞试液变红
B.丙溶液能与戊发生复分解反应生成丁
C.不能由甲通过一步反应生成丁
D.甲→戊必须通过置换反应才能实现
【答案】C
【解析】
A、丁是大理石的主要成分,丁是碳酸钙,甲、戊为氧化物且甲为黑色固体,甲能够转化为戊,戊能转化为碳酸钙,因此甲可以是氧化铜,戊是二氧化碳;乙、丙分别是酸和碱中的一种,且氧化铜、碳酸钙能够和乙反应,因此乙是酸,丙是碱,丁为碳酸钙,丙能转化为碳酸钙,则丙是氢氧化钙,带入验证符合转化关系。乙是酸,不能使无色酚酞试液变成红色,故A错误;
B、由上述分析可知丙是氢氧化钙,戊是二氧化碳,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,但不属于复分解反应类型,故B错误;
C、由上述分析可知,甲是氧化铜,丁是碳酸钙,氧化铜是不能一步反应产生碳酸钙的,故C正确;
D、由上述分析可知,甲是氧化铜,戊是二氧化碳,氧化铜可以和碳、一氧化碳反应产生二氧化碳,不一定通过置换反应实现,故D错误。
故选C。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:初中化学 来源: 题型:
【题目】现有三种常见治疗胃病药品的标签:
消化药片 每片含 碳酸钙 |
减缓胃痛 每片含 氢氧化镁 |
帮助消化 每片含 氧化镁 |
① | ② | ③ |
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是( )
A.①![]() ②
②![]() ③B.①
③B.①![]() ②
②![]() ③C.③
③C.③![]() ②
②![]() ①D.②
①D.②![]() ③
③![]() ①
①
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程。
(工艺流程及原理)
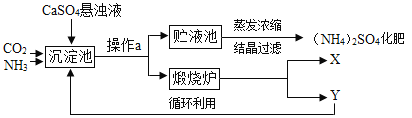
沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
(讨论交流)
(1)操作a的名称是_____,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要_____。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用。X的化学式为_____,Y的化学式为_____。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们接触过的有些化学反应是无明显现象的。如图三个实验都是通过滴加其他试剂的方法,使之产生明显的现象,以证明反应确实发生了。请回答下列问题:

(1)实验甲中能证明反应发生的现象是溶液由________色变为无色,此时溶液中一定不含有的溶质是__________。
(2)实验乙中要证明反应的确发生了,应选用的酸碱指示剂是______________。
(3)受到甲、乙实验的启发,玲玲同学认为实验丙中的试剂也可以选用无色酚酞试液,但同学们马上表示反对,理由是___________________________________。小明同学则选用甲反应后的溶液滴入丙试管中,观察到先有气泡产生,后有白色沉淀生成。由此既证明了氢氧化钠溶液能与二氧化碳反应,又推断出甲试管反应后溶液中含有的溶质是____________(除指示剂外);请写出丙试管中生成白色沉淀的化学方程式________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示.则有关说法中不正确的( )

A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为8: 1
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验图1
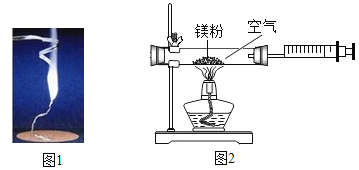
(1)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量.待镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条的质量小,出现此现象的原因是_______________。
小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,难溶于水且不与水反应;
②镁能与氮气反应只生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应,反应的化学方程式为![]()
④氢氧化镁是不溶于水的固体,且受热易分解生成氧化镁和水
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B
| (2)现象:________________ 结论:燃烧产物含Mg3N2 |
[拓展延伸]
(3)如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数_______1/5 (填“大于”、“小于”或“等于”)
(4)请选择下列正确的实验方案将混在氧化镁中的氮化镁除去____________
A将混合物直接蒸馏
B将混合物直接过滤
C将混合物溶于水,待充分反应后过滤,再将滤渣在常温下干燥.
D将混合物溶于水,待充分反应后过滤,再将滤渣充分加热至固体质量不再变化
(5)将足量的镁条放在含氮气和氧气质量比为7: 2的混合气体中充分燃烧反应,再将生成的固体物质与足量水反应产生气体质量为34g,求消耗镁条的质量为______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系,是化学学科的特点,如图是某化学反应的微观过程示意图(“![]() ”表示氧原子,“〇”表示氢原子).
”表示氧原子,“〇”表示氢原子).
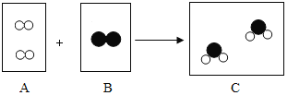
(1)从微观角度看,物质C属于__(选填“混合物”或“纯净物”);物质B是由____构成的(选填“分子”或“原子”或“离子”);
(2)一个C分子是由___个原子构成;
(3)此反应的符号表达式为______________;此反应属于_________反应(填基本反应类型).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com