
【题目】在一定条件下,A和B能发生化学反应生成C和D,其微观示意图如下所示:

请回答下列问题:
(1)上述反应过程中,属于氧化物的是①______(填字母),从微观的角度说明你判断的依据是②_______________。
(2)该反应的的化学方程式为________。属于________反应(填基本反应类型)
(3)画出比一个B分子少一个电子原子结构示意图:_____。
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】芬太奴(C20H24N2O)是医疗上常用的麻醉剂,下列说法正确的是( )
A.芬太奴的相对分子质量是308g
B.芬太奴中含有24个氢原子
C.芬太奴中氢元素的质量分数最大
D.芬太奴是一种有机物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图 1 所示实验。
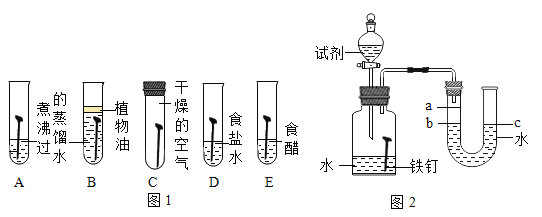
①通过观察实验 A、B、C 中的现象,经过科学严谨的推理得出结论:铁锈蚀是铁与____________发生化学反应的过程。
②实验 D 和 E 的目的是进一步探究铁在盐溶液和酸的环境中是否更容易锈蚀。铁跟醋酸(CH3COOH) 反 应生成醋酸亚铁[ (CH3COO)2Fe ]和氢气 ,请写出反应的化学方程式____________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)氯化钠溶液能导电;乙醇溶液不能导电。
(猜想假设)铁的锈蚀速率与下列因素有关:
I._________________;
II.氧气的含量;
Ⅲ.水溶液的导电性。
(实验探究)每次取两套如图 2 所示的装置,编号为甲、乙。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
影响 因素 | 实验设计 | 实验现象 | 实验结论及解释 |
I. | 装置甲放入 25℃恒温环境中, 装置乙放入 40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且 U型管中液面均由 b 处上升至 a处,所需时间甲>乙 | ____________ |
II. | 在相同温度下,向甲、乙两套装置的集气瓶中分别通入氧气和空气。 | 铁钉均锈蚀,且 U 型管中液面由 b 处上升至 a 处,所需时间甲___________乙 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
Ⅲ. | ______________________ | 两套装置中铁钉均锈蚀,且 U 型管中液面均由 b 处上升至 a 处,所需时间甲<乙 | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,铁的锈蚀速率加快。 |
(反思与提高)根据该探究实验以及你所学的知识,判断下列说法正确的是___________(填序号)。
A 金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B 金属腐蚀不一定要有氧气参加
C 金属越活泼,就越容易被锈蚀
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Cl2是黄绿色气体,水溶液叫氯水,把品红试纸伸入氯水中,品红试纸褪色。
[提出问题]氯水中的哪些成分能使品红试纸褪色呢?
[查阅资料]氯气溶于水,部分与水反应,方程式为![]() 。HClO(次氯酸)是一种弱酸,具有强氧化性。
。HClO(次氯酸)是一种弱酸,具有强氧化性。
[猜想假设]猜想1:氯水中的水使品红褪色;猜想2:氯水中的Cl2使品红褪色;
猜想3:氯水中的__使品红褪色;猜想4:氯水中的HClO使品红褪色。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
1.把品红试纸伸入水中 | 没有褪色 | 猜想1__ |
2.____ | 没有褪色 | 猜想2不成立 |
3.把品红试纸伸入稀盐酸中 | _ | 猜想3不成立 |
[实验结论]综合分析判断:氯水中的__(填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。
[拓展应用]①向氯水中滴加紫色石蕊溶液,观察到的现象是___;②氯水中加人AgNO3溶液有白色沉淀生成,化学方程式为__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学小组同学在一次实验中进行了如图所示的实验:
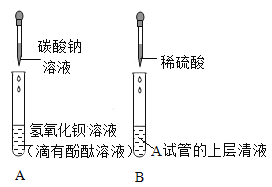
先向A中已有的溶液中滴入碳酸钠溶液,反应的化学方程式是_______;静置,将上层清液倒入B试管中,滴加一定量稀硫酸,开始时无明显现象,后出现气泡。则A溶液中的溶质为_________ 。(不考虑酚酞)
(提出问题)小组同学对加稀硫酸后所得溶液B产生了浓厚的兴趣,进行了进一步的探究活动。溶液B中含有那些离子。
(猜想与假设)小惠猜想:Na+ 、SO42-、H+
小胜猜想:Na+ 、SO42- CO32-
小利猜想:Na+ 、SO42- CO32-、OH-
(表达与交流)通过讨论大家认为小利猜想不成立,理由是_______;
(探究实验)小胜认为可以另取一定量的B溶液,加入足量的氯化钡溶液,观察到了_______的实验现象,即可验证溶质成分。
(归纳与总结)通过以上探究活动,小组同学总结出:分析反应后溶液中溶质成分时,不仅要考虑可溶性生成物一定存在,和____可能存在 ,还要结合实验现象,进行合理猜想;在确定反应后溶液中溶质的成分时,对所加试剂的要求有____(答一条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了图所示实验流程.
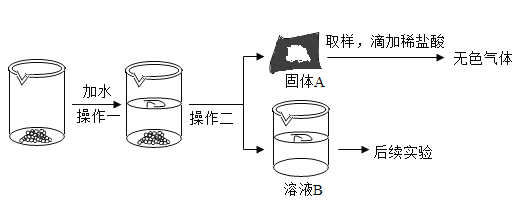
请你参与探究过程:
(1)为了使样品充分溶解,操作一中还要用到的玻璃仪器是__;操作二的名称是__.
(2)固体A中一定含有__.
(3)溶液B成分的探究.
(查阅资料)
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性且能与碳酸钠发生复分解反应.
(猜想)溶液B中溶质可能为:①NaOH ②Na2CO3③NaOH和Na2CO3④Ca(OH)2和__
(设计方案并进行实验)甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,他做了如下实验.
实验步骤 | 实验现象 | 实验结论 |
①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 | __ | 猜想③正确 |
实验步骤①的目的是__.
(4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是__(填序号).
A 一定有
B 一定有Na2CO3
C 一定有CaO
D 至少有NaOH、CaO中的一种.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图所示装置回答有关问题:
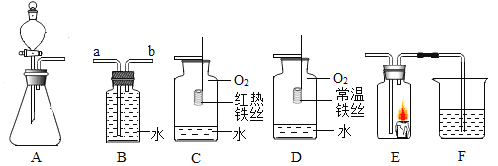
(1)装置 A 的优点是_________。
(2)若用装置 B 排水法收集氧气,气体从______________(填“a”或“b”)端导管通入瓶内。
(3)对比装置 C 和 D,可以得出可燃物燃烧的条件是______________。
(4)某同学连接 A、E、F 进行实验,A 中所加药品不同,F 中所加药品相同。
①若实验时 E 中蜡烛熄灭,F 中溶液变浑浊,则 A 中反应的化学方程式为______________;
②若实验时 E 中蜡烛燃烧更旺,F 中溶液变浑浊,则 A 中反应的化学方程式为______________;
③实验时 F 中溶液的作用是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化锰和过氧化氢酶均能催化过氧化氢分解制取氧气。为比较两者的催化能力,小明按图甲所示装置进行了如下实验。
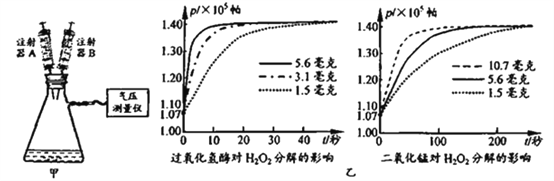
①取1.5毫克过氧化氢酶和8毫升蒸馏水加入容器中,搅拌后塞紧橡皮塞。
②用注射器A从容器中抽出2毫升气体,用注射器B将2毫升H2O2溶液注入容器中,采集数据.直至反应结束。
③用3.1毫克、3.6毫克过氧化氢酶及1.5毫克、5.6毫克、10.7毫克二氧化锰重复上述实验,获取数据如图乙。
(1)步骤②将注射器B中的2mL H2O2溶液全部注入容器前,用注射器A先从容器中抽出2毫升气体,其目的是__________。
(2)小明分析相关数据,得出“过氧化氢酶对过氧化氢的催化能力比二氧化锰强”这一结论,其依据是_____________。
(3)查阅资料得知:过氧化氢分解为放热反应。小明推测:过氧化氢酶质量过大,可能导致实验过程中过氧化氢分解突然变慢。请说明其理由:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com