
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是_____(填字母,下同)。
A 铁钳 B 铁锅 C 刀具
(2)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理________。
(3)某品牌的麦片中含微量铁粉,食用后可在胃酸(主要成分是盐酸)的作用下转化为人体可吸收的铁元素,反应的化学方程式为______________。
(4)“纳米α-Fe粉”可用于食品保鲜,称为“双吸剂”,因为它能吸收空气中的____和_____。
II.铁的冶炼。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:________;
(2)高炉炼铁中,焦炭的作用_________,_____。(用化学方程式表示)
Ⅲ.实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
(查阅资料):
①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
②NaOH溶液可以吸收二氧化碳。
③浓硫酸是一种常用的干燥剂。于是他设计了下图的实验装置,结合装置回答下列问题:
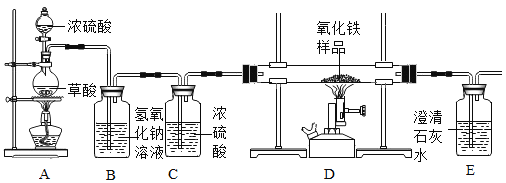
(1)图中装置C作用是_____________;
(2)装置E中澄清石灰水的作用是_______;
(3)从实验操作程序和实验安全看,首先要检查装置的气密性,实验开始先加热_____(填A或D)处。实验结束应_____(先或后)停止加热该处,这样做的主要目的是_______。
(4)该装置设计有一个明显缺陷,你认为是____________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当D中固体全部变黑后,停止加热,继续通入CO直到玻璃管冷却。将得到的黑色固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
(查阅资料):a.铁的氧化物在足量的稀盐酸中均能全部溶解,但无气泡产生。
b.Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②__________ ;③Fe3O4 和FeO。
(6)定量分析 用电子天平称量得部分数据如下:(玻璃管质量60.0 g)
反应前 | 反应后 | |
玻璃管及其中固体的质量 | 66.0g | 65.8 g |
根据上述数据,纯净的Fe2O3固体质量为_______g,通过上述数据,可推断出反应后黑色固体的成分_________, 根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:_____。
【答案】B Fe+ CuSO4 =Cu + FeSO4 Fe +2HCl=FeCl2+H2↑ 水分 氧气 Fe2O3+3CO ![]() 2Fe+3CO2 C+O2
2Fe+3CO2 C+O2![]() CO2 CO2+C
CO2 CO2+C![]() 2CO 吸收水蒸气 检验是否生成二氧化碳 A D 防止高温条件下铁被空气中的氧气氧化 没有尾气处理装置 FeO 6.0g 四氧化三铁 3Fe2O3+CO
2CO 吸收水蒸气 检验是否生成二氧化碳 A D 防止高温条件下铁被空气中的氧气氧化 没有尾气处理装置 FeO 6.0g 四氧化三铁 3Fe2O3+CO![]() 2Fe3O4+CO2.
2Fe3O4+CO2.
【解析】
I、铁的应用
(1)分析所给三种金属制品可以知道,铁锅是利用了金属的导热性,故选 B。
(2)我国在西汉时期就有“曾青得铁则化为铜”之说,是指铁与硫酸铜反应生成铜和硫酸亚铁,反应的方程式为:Fe+ CuSO4 =Cu + FeSO4
(3)铁与稀盐酸反应生成氯化亚铁和氢气,反应的方程式为: Fe +2HCl=FeCl2+H2↑
(4)铁吸收水与氧气后会变成铁锈,所以“双吸剂”它能够吸收空气中的水分和氧气。
II、铁的冶炼
(1)赤铁矿的主要成分是氧化铁,氧化铁和一氧化碳反应能生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(2)炼铁时要用到焦炭,它有两个作用。炼铁时需要高温,焦炭与氧气反应生成二氧化碳,同时放出大量热,可供给炼铁使用,反应的方程式为:C+O2![]() CO2;炼铁时还需一氧化碳作还原剂,二氧化碳与过量焦炭反应可以生成一氧化碳,反应的方程式为:CO2+C
CO2;炼铁时还需一氧化碳作还原剂,二氧化碳与过量焦炭反应可以生成一氧化碳,反应的方程式为:CO2+C![]() 2CO。
2CO。
Ⅲ.实验探究炼铁原理
(1)图中装置C作用是吸收二氧化碳。故填:吸收水蒸气。
(2)装置E中澄清石灰水的作用是检验是否生成二氧化碳。故填:检验是否生成二氧化碳;(3)从实验操作程序和实验安全看,首先要检查装置的气密性,实验开始先加热A处,以排出装置中的空气,防止发生爆炸;
实验结束应先停止加热D处,这样做的目的除了可将生成的气体全部排出外,还可以起到的目的是防止高温条件下铁被空气中的氧气氧化。
(4)该装置设计有一个明显缺陷,即没有尾气处理装置。
故填:没有尾气处理装置。
(5)根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;②FeO;③Fe3O4 和FeO 。
故填:FeO。
(6)根据上述数据,纯净的Fe2O3固体质量为:66.0g-60.0g=6.0g;
玻璃管及其中固体的质量在反应前后的质量差是氧化铁中减少的氧元素质量,即减少的氧元素质量为:66.0g-65.8g=0.2g,
氧化铁中氧元素质量为:6.0g×![]() =1.8g,铁元素质量为:6.0g-1.8g=4.2g,剩余固体中铁元素、氧元素质量比为:4.2g:(1.8g-0.2g)=21:8,
=1.8g,铁元素质量为:6.0g-1.8g=4.2g,剩余固体中铁元素、氧元素质量比为:4.2g:(1.8g-0.2g)=21:8,
氧化亚铁中铁元素、氧元素质量比为:56:16=7:2,四氧化三铁中铁元素、氧元素质量比为:168:64=21:8,四氧化三铁中铁元素、氧元素质量比是21:8,因此剩余固体是四氧化三铁,该实验中玻璃管内发生的化学反应方程式为:3Fe2O3+CO![]() 2Fe3O4+CO2.
2Fe3O4+CO2.


科目:初中化学 来源: 题型:
【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究二氧化锰能否加快过氧化氢分解 | 探究石蜡燃烧后是否有二氧化碳生成 | 检验氧气是否集满 | 测定空气中氧气的含量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]的流程。请按要求回相关问题:
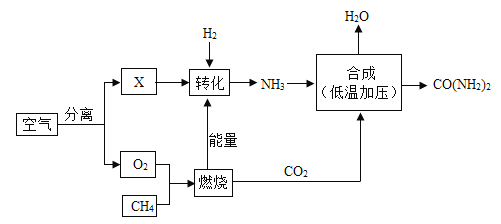
(1)图中分离空气的过程属于_____变化(填“物理”或“化学”)。
(2)X是空气中含量最多的气体,其化学式为_____;物质X与H2转化为NH3的化学反应基本类型为:_____。
(3)尿素[CO(NH2)2]中氮元素的质量分数_____。(结果保留0.1%)
(4)尿素属于氮肥,写出NH3合成尿素的化学反应方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是钠元素和氯元素在元素周期表中的信息和三种粒子的结构示意图。请回答下列问题:
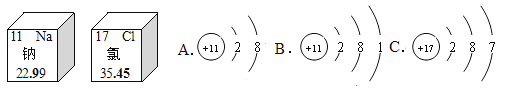
(1)钠原子与氯原子的最本质区别是 。
(2)氯元素属于 (填“金属”或“非金属”)元素。
(3)上述A、B、C三种粒子中,属于同种元素的粒子是_________ (填字母)。
(4)钠和氯气反应生成氯化钠时得电子的是 原子;Na+的结构示意图是 (填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲和乙反应生成丙和丁的微观示意图如下,下列说法正确的是
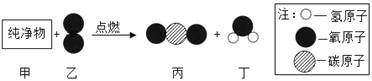
A. 该反应前后分子的种类和数目一定不变 B. 该反应属于置换反应
C. 甲物质中只含有碳、氢两种元素 D. 甲的化学式可能为CH2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据图 1 和图 2 回答下列问题。
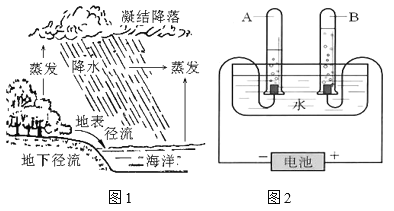
图 1 自然界水循环示意图 图 2 电解水实验示意图
(1)分析图 1 可知,在水蒸发的过程中,下列说法正确的是(填字母) _____;
A 水分子不断运动
B 水分子之间间隔不变
C 氢、氧原子不发生改变
D 水分子大小改变
(2)分析图 2 可知,试管 A 中的气体为 _____,B 中的气体为 _____, 正极和负极产生的气体质量之比为 _____。
(3)在电解水的过程中,下列说法不正确的是(填字母) _____;
A 水分子发生了改变
B 氢原子和氧原子没有发生变化
C 水分子可以保持水的化学性质
D 水分子是由氢分子和氧分子构成的
(4)面临淡水资源的短缺,小袁倡议“一水多用”。请你举出生活中的一项具体措施 _____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。

(1)花青素的相对分子质量为__________。
(2)花青素中碳、氢、氧三种元素的原子个数比为________;
(3)花青素中碳元素的质量分数为_______;(保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】FeCl3溶液常用于蚀刻印刷电路,反应原理为aFeCl3+bCu═cCuCl2+dX.向含溶质32.5g的FeCl3溶液中慢慢加入一定量的Cu粉,反应过程中FeCl3、CuCl2的质量随Cu粉质量变化如图.下列说法不正确的是( )
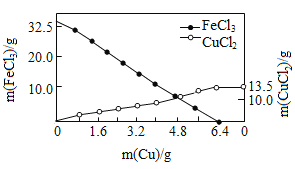
A.方程式中a和c的比为1:2
B.化学计量数d=2
C.完全反应后,生成X的质量为25.4g
D.X为FeCl2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律。如图是元素周期表中1~18号元素原子核外电子排布。
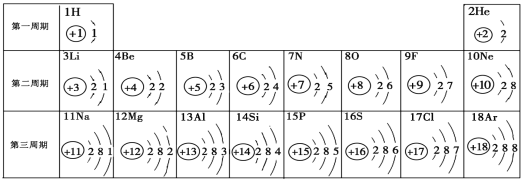
(1)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,同一周期元素原子的_____________ 相同。
(2)11号元素属于______________元素(填“金属”或“非金属”),它在化学反应中形成的离子与____________(写元素符号)原子具有相同的核外电子排布。
(3)表中每一个横行叫做一个周期,每一个纵行叫做一个__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com