
【题目】某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如图操作流程:请回答:
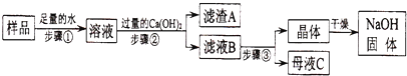
(1)步骤②反应的化学方程式为________;加入过量Ca(OH)2的目的是________
(2)滤液B中的溶质是________、________(写化学式);步骤③所包含的具体操作是加热浓缩、________、过滤.
(3)探究变质NaOH固体中碳酸钠的质量分数.
(设计实验)甲组同学:称取20.0g样品,放入足量的溶质质量分数为14.6%的稀盐酸直到反应停止,共收集到4.40g二氧化碳.
乙组同学:称取20.0g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.0g.
(解决问题)
根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:________.(请写出计算过程 Ca:40 C:12O:16H:1Na:23)
(4)(交流与反思)
在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:________.
【答案】Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 将溶液中的碳酸钠完全转化为氢氧化钠 Ca(OH)2 NaOH 降温结晶 64.6% 因为样品中有水,无法测出样品的氢氧化钠的质量
【解析】
变质的氢氧化钠常会因氢氧化钠与二氧化碳反应含有碳酸钠,碳酸钠与氢氧化钙反应会生成碳酸钙与氢氧化钠,为把碳酸钠清除的更干净一些常会加入过量的氢氧化钙.
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;将溶液中的碳酸钠完全转化为氢氧化钠.
(2)由于溶液中加入了过量的氢氧化钙,所以滤液中会含有氢氧化钠与氢氧化钙,因为这两种物质的溶解度随温度的变化差异很大,故可采用降温结晶的方式进行分离.
故答案为:Ca(OH)2;NaOH;降温结晶;
[解决问题]
设样品中碳酸钠的质量为x,
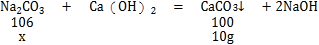
![]()
解得x=10.6g
所以:品中碳酸钠的质量分数![]()
[交流与反思]
因为样品中有水,无法测出样品的氢氧化钠的质量,所以以上数据不能计算出样品中氢氧化钠的质量分数,所以答案为:样品中有水,无法测出样品的氢氧化钠的质量.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】蛋白质是六大基本营养素之一,它是由多种氨基酸(如丙氨酸,其化学式为C3H7O2N)构成的极为复杂的化合物,成年人每天需摄取60~70g,处于生长发育期的青少年需要量更大。
(1)丙氨酸属于__________(填“无机物”或“有机物”)
(2)丙氨酸由______种元素组成,其中C、N两种元素的质量比为______(填最简整数比)。
(3)17.8g丙氨酸中所含氮元素的质量为________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O===2Ca(OH)2+O2↑。某同学把20g不纯的过氧化钙样品(杂质不与水反应)加入到盛有50g水(足量)的烧杯中,完全反应后,称量烧杯内物质的总质量为66.8g。请计算:
(1)生成氧气_____g;
(2)该样品中过氧化钙的质量分数_____。(根据化学方程式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
(提出问题)滤液中溶质的成分是什么?
(猜想与假设)
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想____不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ____ | 猜想三成立 |
(反思与拓展)①若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20 ℃时,取18 g KNO3和18 g NaCl分别放入两只烧杯中,各加入50 mL水(水的密度为1 g/mL),充分溶解,现象如图甲所示;升温到50 ℃时,现象如图乙所示。KNO3和NaCl的溶解度曲线如图丙。请回答下列问题:
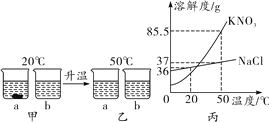
(1)a烧杯中加入的物质是______(填化学式)。
(2)甲图中,a烧杯溶液中溶质的质量分数______(“>”、“<”或“=”)b烧杯溶液中溶质的质量分数。
(3)要使乙图中的NaCl溶液恰好变成饱和溶液,需要加入________g NaCl固体。
(4)除去NaCl固体中混有的少量KNO3,实验步骤:先加水溶解,再________,然后过滤、洗涤、干燥。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答下列问题:
(1)有的胃病患者胃酸过多,常服用一些含氢氧化铝的药物,有关反应的化学方程式为_____。
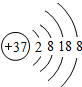
(2)铷(Rb)是一种银白色蜡状金属,质软而轻,其化学性质比钾活泼。下图表示铷元素的_____(填“原子”、“阳离子”或“阴离子”)结构示意图。由图可知,铷元素应位于元素周期表中的第_____周期,硫酸铷的化学式为_____。
(3)为维护食品安全,卫生部禁止在面粉中添加增白剂,如过氧化钙(CaO2)等。它和水反应能生成一种碱和一种无色能供给人呼吸的气体,该反应的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门富有创造性的科学,在生产生活中做出了重大贡献。含氟物质的合成,对推动社会进步发挥着巨大作用。
(1)画出氟元素的原子结构示意图______,由氟原子的结构示意图知,氟原子在化学反应中容易______(填“失”或“得”)电子。
(2)氟化钠常用作牙膏添加剂,能有效预防龋齿。氟化钠和氯化钠一样,都是由______(填“分子”“原子”或“离子”)构成。
(3)一氧化二氮(N2O)又称“笑气”,其麻醉作用在200多年前就被发现。一氧化二氮属于______(填“纯净物”或“混合物”)。
(4)下列信息中,描述了一氧化二氮化学性质的是______(填字母序号)。
A 无色有甜味的气体,密度比空气大
B 在高温下能分解生成氮气和氧气
C 常压下熔点-90.8℃,沸点-88.5℃
(5)锂(Li)是最轻的固态金属,锂做负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用。锂原子的核电荷数为______,有______个电子层。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水素有“液体工业原料”之美誉。工业“从海水中提取镁”的主要流程如图:
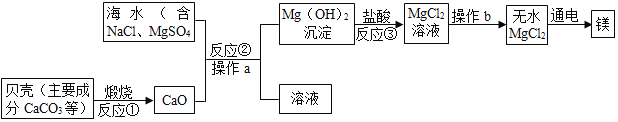
(1)反应①煅烧过程中生成的另一种氧化物是_____(填物质名称)。
(2)操作b的名称是_____,操作a、b中都要用到一种玻璃仪器该仪器在操作a中的作用是_____。
(3)以上提取镁的全过程中没有涉及的化学反应类型是_____(填基本反应类型),写出反应③的化学方程式:_____。
(4)该反应生产生石灰的主要原料来源于海洋中的贝壳,优点是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食醋是厨房中常用的調味品,其中含有醋酸。醋酸的化学式为CH3COOH,请回答:
(1)醋酸属于_____化合物(填“有机”或“无机”)。
(2)醋酸的相对分子质量是_______;
(3)醋酸中碳、氢两种元素的质量比是_______;
(4)_____g醋酸中含6.4g氧元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com