
【题目】高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂。干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气。根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是___________________________________________;
(2)高铁酸钾中铁元素的化合价为__________________;
(3)保存高铁酸钾时应注意_____________________________________________;
(4)试完成高铁酸钾与水反应的化学方程式。![]() ____↑
____↑
【答案】紫色光泽的微细结晶粉末 +6 防热防潮(或低温干燥,阴凉干燥,防热避潮等) 3O2
【解析】
(1)根据题中信息可知,高铁酸钾的物理性质有:紫色光泽的微细结晶粉末;
(2)高铁酸钾中钾元素显+1价,氧元素显-2价,设:高铁酸钾中铁元素的化合价为x,根据在化合物中正负化合价代数和为零,则有:(+1)×2+x+(-2)×4=0,则x=+6;
(3)根据干燥的高铁酸钾在198℃以下是稳定的,受热易分解,所以保存高铁酸钾应注意:防热防潮(或低温干燥,阴凉干燥,防热避潮等);
(4)根据反应的化学方程式可知,反应前有8个钾原子,4个铁原子,20个氢原子,26个氧原子,反应后有8个钾原子,4个铁原子,20个氢原子,30个氧原子,根据质量守恒定律,化学反应中原子的种类和数目不变,故生成的气体为氧气,且分子个数为3,故填:3O2。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
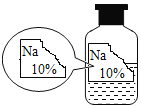
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过询问老师后知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断是否变质,化学小组的同学进行了如下的探究活动:
(进行猜想)
猜想Ⅰ:原溶液的溶质是NaCl;
猜想Ⅱ:原溶液的溶质是NaOH;
猜想Ⅲ:原溶液的溶质是Na2CO3;
猜想Ⅳ:原溶液的溶质是NaHCO3。
(查阅资料)常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为①_____。
(进行实验)
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是②_____。
(2)同学们另取样品又进行了入如下实验,实验过程如下:
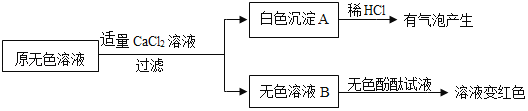
①生成白色沉淀A的化学方程式 ③_____。
②通过实验可以判断样品无色溶液中含有的溶质有 ④_____。
(获得结论)实验完成后,经过同学们讨论,最终得到的结论:原瓶中的溶质是 ⑤_____,且已变质。
(拓展应用)要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的 ⑥_____ (填序号)。
A Ba(OH)2 溶液 B BaCl2溶液 C Ca(OH)2 溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是( )

A. 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成
B. 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁
C. 反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成
D. 为了减少空气污染,应增加尾气处理装置
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比实验是重要的探究方法,下列关于实验的说法不正确的是( )
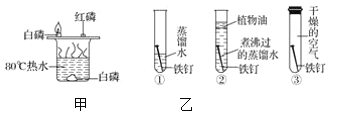
A. 甲可探究燃烧物燃烧是否需要氧气
B. 甲实验中水中白磷不燃烧是因为温度未达到着火点
C. 乙可探究铁生锈是否与空气中的氧气、水都有关系
D. 乙实验中①②对比可探究铁生锈是否与氧气有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
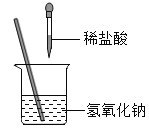
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有不纯的氧化铜样品16g,所含杂质可能是氧化铝、氧化镁、木炭粉、氯化钠。向其中加入200g溶质质量分数为![]() 的稀硫酸,恰好完全反应,没有固体剩余。则下列判断不正确的是( )
的稀硫酸,恰好完全反应,没有固体剩余。则下列判断不正确的是( )
A. 原固体样品中肯定不含木炭粉B. 原固体样品中可能含有氯化钠
C. 反应生成![]() 水D. 反应后所得溶液中含有两种溶质
水D. 反应后所得溶液中含有两种溶质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):
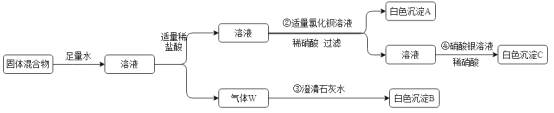
根据流程图回答问题:
(1)反应③的化学方程式为_____,反应④的化学方程式为_____。
(2)根据实验现象推断该混合物中一定含有的物质是_____(填化学式)。
(3)该同学为了进一步确定固体混合物的组成,取样品20.9g(其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是_____(填化学式),其质量为_____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某黑色粉末含有氧化铜、碳粉、铁粉中的一种或多种,做如下探究:将ag黑色粉末加入到盛有100.0g稀硫酸的烧杯中,充分反应后称得烧杯内物质质量为(99.8+a)g。对实验的推理正确的是( )
A. 反应后烧杯内物质含有硫酸铁
B. 该稀硫酸的溶质的质量分数不低于9.8%
C. 原黑色粉末中一定含有铁粉,且铁粉的质量一定为5.6g
D. 若反应后烧杯内有黑色粉末剩余,则原黑色粉末中一定含有碳粉
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数.
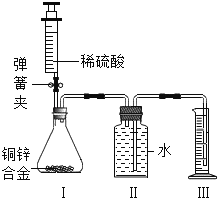
探究过程如下:
①连接实验装置并检查装置气密性.
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应)
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g.
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数.
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L.
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为 ,实验过程中须加入稀硫酸至不再产生气体,目的是 .
(2)步骤③中称量剩余固体之前的正确操作是 、洗涤、干燥.
(3)根据实验测定的数据,上述三位同学中 (填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数.
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差.以下因素可能造成偏差的有 (填标号).
A.移出装置Ⅲ时,导管内留存了一部分水
B.实验测量前,没有排除装置Ⅰ中的空气
C.数据处理时,未排除加入稀硫酸所占的体积.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com