
【题目】下图体现了稀盐酸和氢氧化钠溶液反应的实质,请回答有关问题:
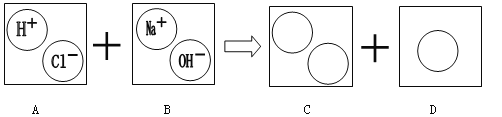
(1)在上图C、D中的圆圈内填入适当的化学式或离子符号:C中_______、_______,D中________;
(2)用化学方程式表示图中所体现的化学反应______________________________;
(3)以上变化的反应类型是_______________。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产氯化钙晶体的流程如下。原料石灰石中含有杂质主要是MgCO3、MgSO4 和Al2O3。
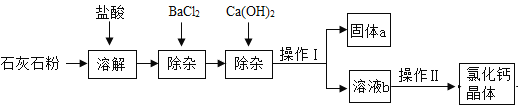
⑴石灰石粉溶解时,Al2O3发生反应的化学方程式为________________。
⑵加入BaCl2除去的杂质离子是____________(填离子符号);
⑶操作Ⅰ的名称为____________,需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、____________。操作Ⅱ的具体步骤为:____________、冷却结晶。
⑷固体a的成分一定含有________________________(只写一种)。检验溶液b的酸碱性,如果显碱性,还需加入适量的____________ (填化学式)提高产品纯度。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钙是一种重要化工原料,广泛用于建筑、造纸、食品和医药等工业。
Ⅰ 高纯碳酸钙的制备
一种以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如下:
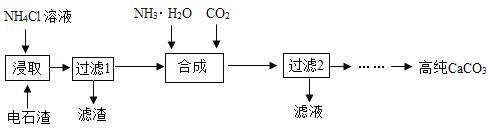
(1)“浸取”的主要目的是将Ca(OH)2转变成CaCl2,同时还产生有氨味的气体)。“浸取”时反应的化学方程式为_____。
(2)“过滤2”得到的滤液中一定含有的物质是_____(填化学式)。
Ⅱ 碳酸钙的应用
(3)大理石主要成分为CaCO3,另外还含有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
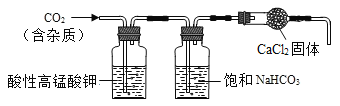
①装置中的酸性高锰酸钾用于除去CO2气体中的含硫化合物,饱和NaHCO3溶液是用于除去CO2气体中的______,CaCl2固体用于干燥CO2。
②实验室常用______检验CO2气体,实验现象为_____。
(4)工业上用石灰石浆吸收废气中的二氧化硫并制取石膏(主要成分为硫酸钙)的流程如下图。

已知反应吸收塔里的反应为:2CaCO3+2SO2+O2=2CaSO4+2CO2。
①流程中石灰石加水制成石灰浆的目的是_____。
②反应前后硫元素的化合价______(填“升高”或“降低”),氧元素的化合价______(填“升高”或“降低”),该反应属于氧化还原反应。
③减少二氧化硫的排放,主要为了______(填序号)。
A 减缓温室效应 B 减少酸雨形成 C 防止破坏臭氧层
④按上述方法处理2000吨废气中的二氧化硫,至少需要含5吨碳酸钙的石灰石浆。废气中二氧化硫的质量分数为______。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号或化学式填空:
(1)2个氢原子_____________ 。
(2)2个氮分子_____________。
(3)+2价的铁元素_________________。
(4)氢氧根离子____________。
(5)氧化镁____________。
(6)碳酸钠_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
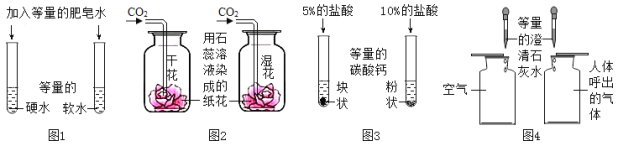
A.图1,区分硬水和软水
B.图2,探究CO2与水的反应
C.图3,探究接触面积对反应速率的影响
D.图4,比较空气与人体呼出的气体中CO2含量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。请计算:
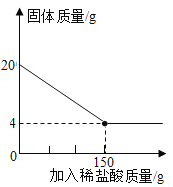
(1)20g赤铁矿石样品中氧化铁的质量_______。
(2)计算该样品中铁元素的质量分数_______,由此判断该赤铁矿石是否属于富铁矿石_______。
(3)实验中所用稀盐酸溶质的质量分数_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量的CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法错误的是( )
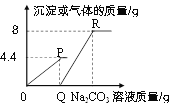
A. P点时的溶液只含一种溶质
B. R点对应横坐标的数值为180
C. 0至P过程中溶液的pH变大
D. Q至R段表示生成沉淀的过程
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤II:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤III:取步骤II所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)步骤II中溶液的红色褪去,发生反应的化学方程式是_________________________。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是____________________。
(3)若要进一步确定样品的组成,还需进行的实验操作是_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,制取烧碱的工艺流程图如图所示:
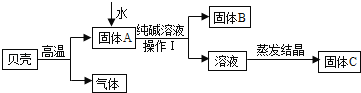
(1)高温煅烧时,要将贝壳进行粉碎的目的是_____,发生反应的化学方程式是_____;
(2)操作Ⅰ中用到的玻璃仪器有烧杯、_____、_____;
(3)若要得到的固体C是纯净的烧碱,需要控制的条件是_____,溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com