
【题目】某研究小组为探究影响铁制品锈蚀及快慢的因素,设计了如下两个实验,依据实验回答下列问题。(已知:氯化钙可作干燥剂;稀氨水呈碱性)
实验一:探究铁制品生锈的条件
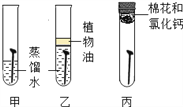
实验二:探究影响铁制品锈蚀快慢的因素(稀氨水和稀醋酸的质量分数相同)
| 实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 | |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 | |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)实验一的乙中植物油的作用是____。
(2)由实验一探究铁制品生锈结果可知铁锈中含有的元素是____。
(3)实验②和④可探究_____因素对铁制品锈蚀快慢的因素;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是_____(填实验序号)。
(4)由实验二表中实验现象得出的结论是______ 。
【答案】 隔绝氧气 铁、氧、氢 温度 ①和②或③和④ 在稀醋酸质量分数相同时,温度越高,铁制品腐蚀越快
【解析】(1)铁生锈是铁与氧气、水共同作用的结果,所以防锈的方法有隔绝氧气、保持金属表面洁净干燥、改变金属的组成和结构;实验一的乙中植物油的作用是隔绝氧气;(2)据质量守恒定律可知,反应前后元素的种类不变,由实验一探究铁制品生锈是铁、氧气、水三种物质间的作用,可知铁锈中含有的元素是铁、氧、氢;(3)实验②和④可探究温度对铁制品锈蚀快慢的因素;据控制变量原则,欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是①和②或③和④;(4)由实验二表中实验②和④所用稀醋酸一样,温度不同,铁制品腐蚀需要的时间不同,且温度越高,铁制品腐蚀越快。故由现象得出的结论是在稀醋酸质量分数相同时,温度越高,铁制品腐蚀越快。


科目:初中化学 来源: 题型:
【题目】元素化学性质与最外层电子数有密切关系。钾原子的结构示意图为![]() ,下图表示的微粒中共有_________种元素,其中与钾原子具有相似化学性质的是_______,B与C形成化合物的化学式为__________。
,下图表示的微粒中共有_________种元素,其中与钾原子具有相似化学性质的是_______,B与C形成化合物的化学式为__________。
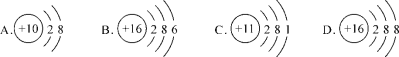
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源。
(1)下图左是某同学所画的自制简易净水器示意图。
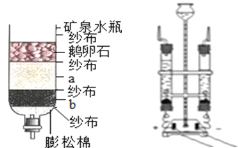
制作材料:见图标注,则a是________ ,b是_________。
使用说明: 使用一段时间后,有关物质吸附杂质已达饱和。这时清洗后可以继续使用的是纱布、石英砂和__________,需要更换的是膨松棉和________ 。
(2)实验室进行过滤操作时,玻璃仪器除了烧杯、漏斗外还需要 ________,其作用是 _________。
(3)生活中常用_____来区分硬水和软水,生活中降低水的硬度的方法是________。
(4)电解水实验如上图右所示,与电源正极相连的玻璃管中生成的气体是_____,该反应的化学方程式为_________。下列关于电解水的说法中不正确的是______(填序号).
A.水分子发生了改变 B.氢原子和氧原子没有发生变化
C.水是由氢元素和氧元素组成 D.水分子是化学变化中最小的微粒
(5)北京极度缺水,应提倡节约用水.下列节水措施合理的是___(填序号).
a.用淘米水浇花 b.用喷灌、滴灌方法给农作物浇水
c.将生活污水、工业废水直接排入河流 d.使用节水龙头
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A、B、C、D、E分别是稀盐酸、氢氧化钠溶液、硫酸铜溶液 、氧化铁和一氧化碳中的一种,E是实验室一种常见溶液,它们之间的关系如图所示,“------”两端的物质在一定条件下可以反应。
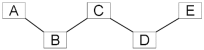
请回答:
(1)E的化学式为___________,该物质属于_______(填:氧化物、酸、碱、盐)。
(2)若F为初中化学常见金属,且能与E反应。则F的化学式为_______,写出F 与E反应的化学方程式:_________________,该反应属于_________(填写基本反应类型)。
(3)若B、C、D、E都不变,五种物质之间的关系也不变,A还可能是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】南海是我国五大海区中最大的海区,自然海区总面积约为350万平方公里,海洋资源丰富,开发前景十分远大。
(1)海洋中有大量的鱼、虾,食用海鱼、海虾可为人体提供的营养素主要是____。(填序号)
A. 糖类 B.蛋白质 C. 维生素 D.油脂
(2)海水中蕴藏着丰富的食盐资源,目前从海水中提取食盐的方法主要为_________
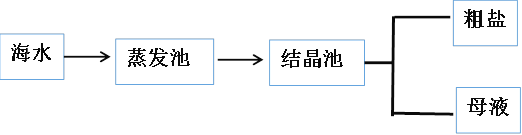
上述过程得到的粗盐属于 ___________(填“纯净物”或“混合物”)。
(3)从海水中可以提取金属镁,金属镁广泛应用于火箭、导弹和飞机制造业。目前世界上60%的镁是从海水(主要含NaCl和MgC2等)中提取的,主要步骤如下:
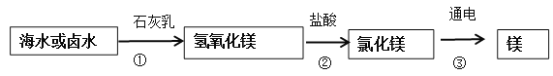
海水中本身就含有氯化镁,则①②两步的作用是 ______________。
(4)海底不仅蕴藏着大量的煤、石油、天然气等常规化石燃料,人们还在海底发现了一种新型矿产资源——“可燃冰”。下列有关“可燃冰”的说法正确的是_________ 。
A.是可再生能源
B.燃烧产物只有水,无污染
C.蕴藏量大,热值大,燃烧后几乎不产生任何残渣和废气,被誉为“未来能源”
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映所对应叙述关系的是

A. 图甲表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系
B. 图乙表示t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入量的关系
C. 图丙表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
D. 图丁表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】聚四氟乙烯俗称“塑料王”, 化学式:(C2F4)n,具有高润滑不粘性等特点,生活中用作不粘锅的 涂层材料,下列叙述正确的是
A. 碳、氟元素的质量比为 1︰2 B. 聚四氟乙烯的相对分子质量为 100
C. 100 g 聚四氟乙烯含氟元素 76 g D. 聚四氟乙烯分子中碳元素的质量分数最大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A﹣F表示初中化学常见的物质,它们之间的转化关系如图所示。

若B是一种金属,在空气中燃烧时,会发出耀眼的白光。D是一种红色单质,F是相对分子质量最小的一种气体。
(1)反应①的化学方程式____________________;
(2)反应②基本反应类型为__________;
若A、B、C表示不同类别的化合物,C、E是同类别化合物,E在常温下是一种无色液体,A溶液可以帮助消化,也可以用来除锈,A还能与F发生反应。
(3)写出E的化学式:_____________;C的化学式为:________________;
(4)写出一个符合题意的A与B反应的化学方程式:______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)是一种新型吸波隐形材料中的增强剂。
(查阅资料)(1) MgCO3·nH2O微溶于水;
(2) MgCO3·nH2O在230℃时开始失去结晶水, 400℃以上时开始分解生成三种氧化物。
I.合成碳酸镁晶须
步骤:①配制一定溶度的MgSO4溶液和NH4HCO3溶液;②量取一定量的NH4HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;③用氨水调节溶液pH至9.5,放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品。
(1)步骤①配制一定溶质质量分数的MgSO4溶液所需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、______________;
(2)步骤②反应的温度控制在50℃,较好的加热方法是__________;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________;
(4)检验沉淀已洗涤干净的方法是:取最后一次洗涤的滤液,滴入_________,若无沉淀说明已洗涤干净。
(5)干燥得碳酸镁晶须产品温度不能过高,目的是______________。
II.测定产品MgCO3.nH2O中的n值
(方案一)将碳酸镁晶须放入A装置中加热(仪器和装置如下图所示),回答下列问题:
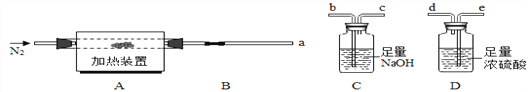
(6)上述装置的连接顺序为_____(按气流方向,用接口字母表示),其中B处的长玻璃导管的作用是__________,C装置的作用是__________。
(7)加热前先通入N2排尽装置中的空气,然后称取C、D的初始质量。再次连接好装置,边加热边通入N2,此时通入N2的作用是_____________。
(8)若B装置中无残留物。装置C反应前后质量差为m1,装置D反应前后质量差m2 。根据以上实验数据,确测定n值, n=___(用含m1、m2的代数式表示)。
(9)有同学提出上述连接好的装置仍不够完善。需要在D装置的后面连接下图装置,目的是________________,否则测得n值会________(“偏大”、“偏小”、“无影响”) 。
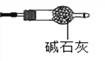
(方案二)
称量100g碳酸镁晶须放入如下图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液加入已知浓度的盐酸恰好完全反应,测得CO2的总量;重复上述操作2次。
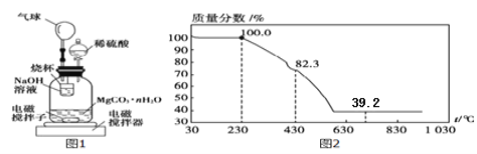
(10)氢氧化钠吸收二氧化碳的化学反应方程式____________________;
(11)图中气球的作用是__________________;
(12)上述反应后期要升温到30℃,主要目的是______________;
(13)设3次实验测得每100 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为ag,则n值为_______(用含a的代数式表示);
(14)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=_______(写出过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com