
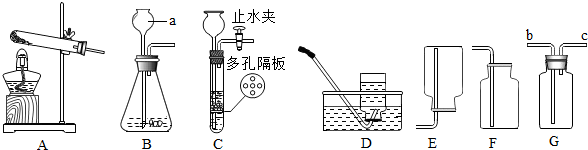
分析 (1)熟悉常用仪器的名称和用途;
(2)根据实验室中加热高锰酸钾制取氧气的反应原理和反应条件来选择反应的发生装置,根据氧气的密度及水溶性来选择收集装置;
(3)根据氢气和空气的密度关系分析若用G装置收集氢气的进气口;
(4)根据装置的特点分析制取二氧化碳最好选用的发生装置,写出反应的化学方程式.
解答 解:(1)由图示可知,装置图中仪器a的名称为长颈漏斗;
(2)采用加热高锰酸钾制取氧气,属于加热固体制取氧气,可选用的发生装置是A,由于氧气不易溶于水,密度比空气略大,所以收集装置可以选择D或F,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)若用G装置采用排空法收集氢气,由于氢气的密度比空气小,氢气应从c进.
(4)实验室常用大理石和稀盐酸反应制取二氧化碳,制取二氧化碳最好选用的发生装置是C,该装置与另一个可选用的装置相比,其主要优点是可以控制反应的发生和停止,反应的化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O.
故答案为:(1)长颈漏斗.
(2)AD或AF,2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)c.
(4)C,可以控制反应的发生和停止,CaCO3+2HCl═CaCl2+CO2↑+H2O.
点评 本题难度不是很大,是中考的重要考点之一,熟练掌握实验室中制取气体的反应原理、发生装置和收集装置的选择依据是正确解答本题的关键.


科目:初中化学 来源: 题型:实验探究题

| CO32- | HCO3- | OH- | |
| Ba2+ | 不溶 | 溶 | 溶 |
| 步骤 | 操作 | 现象 | 结论 |
| 步骤1 | 取该NaOH溶液,加入过量BaCl2溶液 | 产生白色沉淀 | 证明猜想1、5不成立(填数字) |
| 步骤2 | 取步骤1中上层清液,滴加稀盐酸 | 无气泡产生 | 证明原溶液不含HCO3-、CO32-(填“离子”) |
| 步骤3 | 另取步骤1中上层清液,滴加酚酞 | 溶液未变红 | 证明原溶液不含OH-(填“离子”) |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
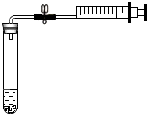 为测定空气中氧气的含量,小明同学设计如下方案:选用容积为40mL的试管作反应器,将白磷放入试管,用橡皮塞塞紧试管口,通过导管与容积为60mL针筒注射器组成如图的实验装置.假设此实验能按照小明的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
为测定空气中氧气的含量,小明同学设计如下方案:选用容积为40mL的试管作反应器,将白磷放入试管,用橡皮塞塞紧试管口,通过导管与容积为60mL针筒注射器组成如图的实验装置.假设此实验能按照小明的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 烧杯 | B. | 蒸馏水、烧杯 | C. | 蒸馏水、玻璃棒 | D. | 澄清石灰水、烧杯 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图表示的是向盛有l0mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液(相同浓度)后,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
如图表示的是向盛有l0mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液(相同浓度)后,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题: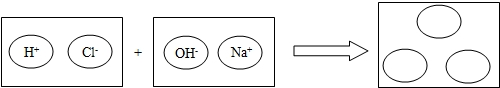
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com