
【题目】下图是钠元素和氯元素在元素周期限表中的信息和3种粒子的结构示意图。请回答复下列问题:
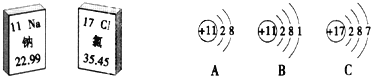
(1)氯原子的核电荷数是_____。C粒子对应元素组成单质的化学式是____
(2)钠和氯气生成氯化钠的反应中,得到电子的是____原子(填字母),A粒子化学式是___
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如图所示实验:(已知:金属银在空气中加热无明显变化)

(1)操作1和操作2的名称是________ ,操作中使用的玻璃仪器有___________________ 。
(2)向样品中加入过量稀盐酸产生的气体的化学方程式是___________________________。
(3)向固体A中加入硝酸银溶液,发生反应的化学方程式为________________________。
(4)固体B中含有的物质是___________________________________________________。
(5)原固体样品中一定含有的物质是___________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了研究物质的溶解现象,进行如下探究活动。
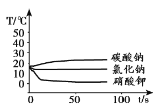
探究I:将足量的碳酸钠、氯化钠和硝酸钾三种物质分别溶解在一定量的水中,溶解过程的温度变化如下图所示。
探究II:
实验 |
① |
② |
③ |
现象 | 固体溶解, 形成紫红色溶液 | 固体溶解,形成紫红色溶液 | 固体几乎不溶解 |
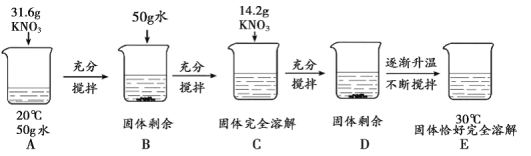
探究III: 探究过程如下图所示:
回答下列问题:
(1)探究I中,溶解过程放出热量的物质是__________。
(2)对探究II中实验现象进行分析,需要做的对比是________。分析得出的结论之一是__________。
(3)探究III中,所得溶液一定属于饱和溶液的是__________。通过该探究得出的结论是__________(答一点即可)。
(4)在上述探究的基础上,同学们想通过探究,比较食盐和氯化铵在水中的溶解度大小,探究方案应该是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
产品原理:该厂采用“侯氏制碱法”生产化工产品﹣﹣纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为:_____;后分离出NaHCO3,加热制得纯碱.
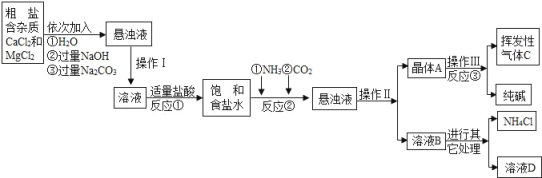
生产流程:
相关资料:
(1)NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
问题讨论:
(1)操作Ⅰ、Ⅱ中,相同操作的名称为_____.反应①中发生了两个反应,写出其中一个化学方程式:_____,反应①加适量的盐酸,适量是指_____.
(2)检验挥发性气体C的方法_____.
(3)上述生产流程中可循环使用的是_____(填序号).
A挥发性气体C; B溶液D; C氢氧化镁;D化肥NH4Cl
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质_____(写化学式).
含量测定:
实验一 | 实验二 | 实验三 | 实验四 | |
固体混合物溶液质量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
生成的沉淀的质量 | 4g | m | 10g | 10g |
称取该纯碱样品44g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
(1)m=_____g;
(2)在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?_____(要求写计算过程,结果保留0.1%)
总结反思:
请通过计算并结合下表判断此纯碱样品等级为_____品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小.
工业纯碱标准:(Na2CO3% ) | |||
优等品 | 一等品 | 合格品 | 次品 |
≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料广泛应用于工业、农业、交通和日常生活等领域。
(1)黄铜、生铁都是生活中常见的两种_____(选填“合金”或“纯金属”)。
(2)体温计中的金属是_____。
(3)铝耐腐蚀是因为表面形成_____(填化学式)。
(4)工业用赤铁矿石炼铁的化学方程式为_____。
(5)钛合金是人造骨的重要材料。要比较钛(Ti)和铁的金属活动性强弱,以下方法不能达到目的是_____。
A 查阅初中化学课本上的金属活动性顺序表 B 利用金属钛和FeCl2溶液进行实验
C 利用金属铁和TiSO4溶液进行实验 D 利用金属钛、铁与稀硫酸进行实验
(6)含有锌6.5g、铁5.6g、铜6.4g、铝2.7g的混合粉末与一定质量的稀硫酸充分反应后,有9.2g固体剩余,则生成氢气质量为_____g,所得溶液中溶质的质量是_____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国大部分地区深受酸雨危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3)。
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色。
(1)酸雨是pH小于______的降雨。
(2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,化学方程式为_______
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式______
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液的中盐成分进行如何探究:
[提出猜想]反应后的混合溶液中盐的成份是什么?
[进行猜想]猜想1:只有K2SO3
猜想2:__________
猜想3:既有K2SO4,也有K2SO3
[实验探究]限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
实验操作 | 实验现象 | 结论 | |
1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | 猜想3成立 | |
2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | _____ | |
3 | 向B试管中,加入_____,再加入足量的_____ | 先有白色沉淀,后有气泡产生,沉淀部分溶解, |
反思与拓展:证明混合溶液中的K2SO4的化学反应方程式为________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活中使用的塑料袋有用聚乙烯制成的,也有用聚氯乙烯制成的。小明同学听说包装食品的塑料袋应该是前者而不是后者,便设计了一个实验方案,用平常在超市买东西时带回来的塑料袋进行探究,以验证其成分。
查阅资料:聚乙烯燃烧生成CO2和H2O;聚氯乙烯燃烧除了生成CO2和H2O之外,还会有HCl气体产生。
实验探究:小明将以下实验装置按ABCD顺序连接好,然后进行探究。
(1)在实验过程中若B、C、D装置都产生明显的现象,则该塑料袋是用______制成的。(填“聚氯乙烯”或“聚乙烯”)
实验反思:连接实验装置时,能否将装置C、D顺序调换?请简述。
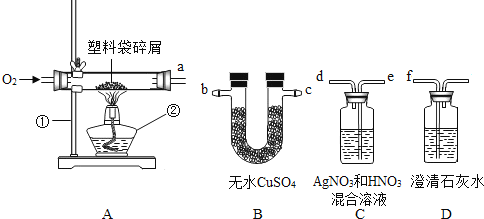
答:______理由是______
继续探究:小明为了测定聚乙烯的组成,取了5.6g聚乙烯塑料碎片放在硬质玻璃管中,鼓入充足的氧气使之燃烧,将产生的气体通入足量的浓硫酸和氢氧化钠溶液中,并将实验结果记录在下表中。实验结果:
实验前 | 实验后 | |
B装置的质量/g | 213.6 | 220.8 |
C装置的质量/g | 200.2 | 217.8 |
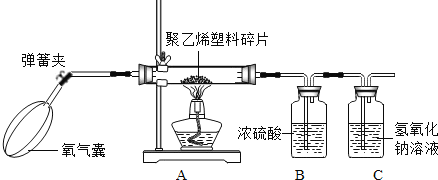
(2)根据实验结果可以判断:聚乙烯燃烧生成的水的质量是______;二氧化碳的质量是______。
(3)聚乙烯中是否含有氧元素______(填“有”或“无”);碳氢元素的质量比为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四种物质在一定条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则有关说法中正确的( )

A. 丙一定是化合物
B. 该反应可能是水的电解
C. 乙一定是该反应的催化剂
D. 参加反应或生成的甲和丙的质量比为19:41
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据如图所示的溶解度曲线回答下列问题.
(1)t1℃时,硝酸钾溶解度_____(选填“>”、“<”或“=”)氯化钠的溶解度;
(2)若想使t2℃的硝酸钾的不饱和溶液变成该温度下的饱和溶液,最简单的方法是_____;
(3)t3℃时将60g硝酸钾溶液50g水中,所得溶液中溶质与溶剂的质量比为_____.
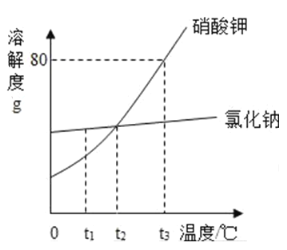
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com