

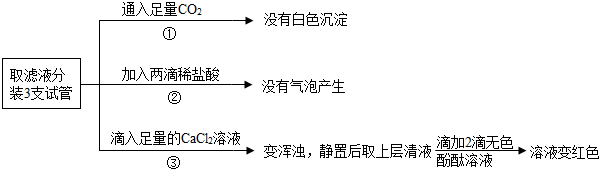
分析 碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳,能和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠溶液显碱性,能使酚酞试液变红色;
氢氧化钠溶液和碳酸钠溶液共存时,滴加稀盐酸时,稀盐酸先和氢氧化钠反应生成氯化钠和水,氢氧化钠完全反应后,稀盐酸再和碳酸钠反应;
氯化钠能和硝酸银反应生成氯化银沉淀和硝酸钠,氯化银沉淀不溶于稀硝酸.
解答 解:取少量溶液甲于烧杯中,测得溶液pH为2,说明甲中含有稀盐酸;
观察到反应中产生沉淀,说明甲中含有氯化钙,乙中含有碳酸钠;
加入乙溶液时立即产生气体,说明乙中不含有氢氧化钠;
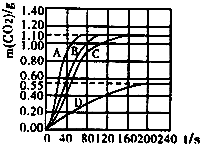
(1)从A到B,烧杯内液体的pH变大的原因是:稀盐酸和碳酸钠反应.
故填:稀盐酸和碳酸钠反应.
(2)图中CD段,溶液中含有碳酸钠,因此溶液显碱性,能使酚酞试液变红色,烧杯内可观察到的现象是溶液变红色.
故填:溶液变红色.
(3)D点时,溶液中一定含有的溶质是NaCl和Na2CO3.
故填:NaCl和Na2CO3.
(4)根据已经掌握的信息可以判定,溶液乙一定含有Na2CO3;一定不含有NaOH.
故填:Na2CO3;NaOH.
(5)为进一步探究溶液乙的成分,该组同学所需试剂是稀硝酸和硝酸银溶液,实验过程是:向乙溶液中加入稀硝酸,再加入硝酸银溶液,如果产生白色沉淀,说明乙中含有氯化钠,反之则不含有氯化钠.
故填:稀硝酸和硝酸银溶液.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 化学实验小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.
化学实验小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.| 实验 编号 | 温度(℃) | 大理石 规格 | 盐酸浓度(均取100mL) | 实验目的 |
| ① | 20 | 粗颗粒 | 20% | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响; |
| ② | 20 | 粗颗粒 | 10% | |
| ③ | 细颗粒 | 20% | ||
| ④ | | 粗颗粒 | 20% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 11.43 | B. | 22.85 | C. | 80.01 | D. | 160.02 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO和CO2的性质不同是因为分子的构成不同 | |
| B. | 在室内放一盆水可防止CO中毒 | |
| C. | 一氧化碳和二氧化碳都具有还原性 | |
| D. | 铅笔字迹易变模糊是因为常温下石墨化学性质活泼 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com