
【题目】碳酸镁水合物是制备镁产品的中间体.
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)获取MgCO33H2O的方法如图1:
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2____.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为___(填字母).
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
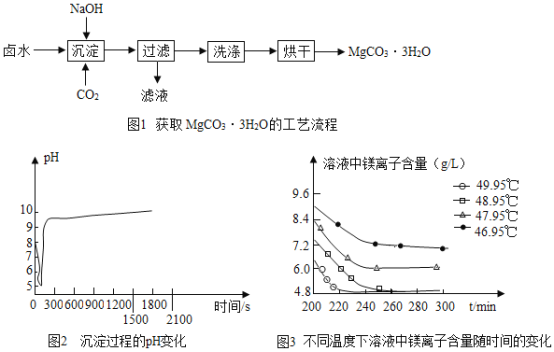
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示.则沉淀过程选择的温度为____,理由是_______。
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
(4)(测定MgCO33H2O的纯度)利用下图进行实验,以确定MgCO33H2O的纯度.
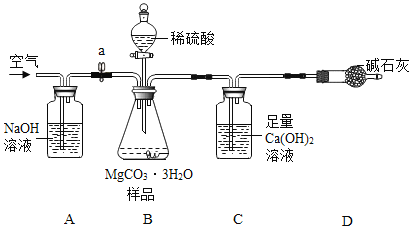
依据实验过程回答下列问题:
(5)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有____。
(6)C中化学方程式为___;A中NaOH作用为___;D中碱石灰作用为____.
(7)下列各项措施中,不能提高测定准确度的是___(填标号).
a 在加入硫酸之前,应排净装置内的CO2气体 b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置 d 在C装置左侧导管末端增添多孔球泡
(8)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO33H2O的纯度___(写出计算过程).
(9)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有____.
(10)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数__(填“偏大”“不变”或“偏小”).
【答案】NaCl c 48.95℃ 此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀 把生成的二氧化碳全部排入C中,使之完全被氢氧化钙溶液吸收,否则装置内剩余的二氧化碳不被吸收,导致测定结果偏小 CO2+ Ca(OH)2 =CaCO3↓+ H2O 吸收空气中的二氧化碳 防止空气中的二氧化碳进入C中,干扰实验,使测定结果偏大 bc 92% 碳酸钡的相对分子质量比碳酸钙的大,等质量的MgCO33H2O生成的碳酸钡质量远大于碳酸钙,实验时相对误差小 偏大
【解析】
(1)化学反应前后各种原子个数相等,故反应的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2NaCl。
(2)根据图2可知,沉淀过程的pH值随时间的变化是先变小后变大,然后保持在9~10之间,而溶液起始的pH值在7~8之间,所以沉淀过程的操作为向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2,故选c。
(3)沉淀过程选择的温度是48.95℃,因为此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
(5)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还能把生成的二氧化碳全部排入C中,使之完全被氢氧化钙溶液吸收,否则装置内剩余的二氧化碳不被吸收,导致测定结果偏小。
(6)石灰水中的溶质是氢氧化钙,与二氧化碳反应生成碳酸钙沉淀和水,故C中化学方程式为:CO2+ Ca(OH)2=CaCO3↓+ H2O;A中NaOH作用为吸收空气中的二氧化碳;D中碱石灰作用为防止空气中的二氧化碳进入C中,干扰实验,使测定结果偏大。
(7)快速滴加硫酸,使生成的二氧化碳的速率太快,不能被充分吸收;在A~B之间增添盛有浓硫酸的洗气装置不能提高测定准确度,因为氢氧化钙不吸收水,故选bc。
(8)MgCO33H2O+H2SO4=MgSO4+4H2O+CO2↑ ,CO2+ Ca(OH)2=CaCO3↓+ H2O,可得关系式为:MgCO33H2O~CO2~CaCO3,设样品中MgCO33H2O的质量为x,
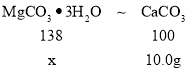
![]() ,解得x=13.8g
,解得x=13.8g
样品中MgCO33H2O的纯度为:![]() =92%
=92%
(9)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有碳酸钡的相对分子质量比碳酸钙的大,等质量的MgCO33H2O生成的碳酸钡质量远大于碳酸钙,实验时相对误差小。
(10)化合物中某元素的质量分数=![]() ,若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数偏大,因为MgCO33H2O中镁元素的质量分数为:
,若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数偏大,因为MgCO33H2O中镁元素的质量分数为:![]() ,而Mg5(OH)2(CO3)44H2O中镁元素的质量分数为:
,而Mg5(OH)2(CO3)44H2O中镁元素的质量分数为:![]() ,同质量的Mg5(OH)2(CO3)44H2O比MgCO33H2O生成碳酸钙沉淀多,所以计算的纯度偏大。
,同质量的Mg5(OH)2(CO3)44H2O比MgCO33H2O生成碳酸钙沉淀多,所以计算的纯度偏大。


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:
【题目】金属材料具有优良的性能,被广泛应用于生产、生活中。
⑴下列金属制品中,主要利用了金属导电性的是_________。(填序号)
A.黄金饰品 B.铁锅 C.铜导线 D.不锈钢刀具
⑵钢铁锈蚀会造成严重的资源浪费,防止或减缓钢铁锈蚀的常用方法有__________。(写出一条即可)
⑶“曾青得铁则化为铜”,这是世界湿法冶金的先驱。试写出用铁和硫酸铜溶液为原料进行湿法炼铜的化学方程式____________,它属于__________ 反应。(填“化合”、“分解”、“复分解”、“置换”之一)
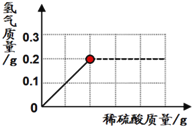
⑷为了测定某黄铜(铜锌合金)样品的组成,某研究性学习小组称取了该样品20g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中,生成气体与所用硫酸溶液的质量关系如下图所示。试计算:该黄铜样品中铜的质量为______________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列各物质中的少量杂质,所选用的试剂、方法都能达到目的的是( )
选项 | 物质 | 杂质(少量) | 操作方法 |
A |
|
| 将混合气体通过灼热的碳粉 |
B |
|
| 加入适量氢氧化钙溶液,过滤 |
C | 铁粉 |
| 加入适量的稀盐酸,过滤 |
D |
|
| 加入适量 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上以黄铁矿(主要成分是FeS2)为原料生产硫酸,请结合生产硫酸的简要流程图完成下面的问题:
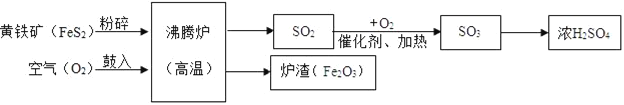
(1)写出流程图中一种氧化物的名称__;
(2)将黄铁矿粉碎,目的是__;
(3)流程中SO3转化为H2SO4的化学方程式为__;
(4)实验室稀释浓硫酸的正确操作方法是__.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是( )
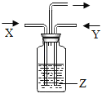
序号 | 气体X | 气体Y | 液体Z |
A | H2 | N2 | 水 |
B | HCl | CO2 | 石灰水 |
C | CO2 | O2 | 氯化钙溶液 |
D | CO2 | CO | 足量石灰水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)已知某粒子的结构示意图为:
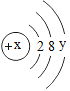
试回答:①当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,粒子可能为:______(填一种离子符号)。
(2)从Ca、Na、C、H、O、N、Fe七种元素中选择适当的元素,按要求填空。
用适当的数字和符号填空:
①3个亚铁离子______;②氨气中氮元素的化合价_____;
写出符合下列要求的物质的化学式:
①造成“温室效应”的物质______;②一种最理想的清洁、高能燃料_____;
③烘焙糕点用的发酵粉中含有的盐是_____;④作为建筑材料用的碱_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镓是一种放在手心就会熔化的金属。如图,①是镓元素在元素周期表中的部分信息,②是镓原子的结构示意图。请回答:
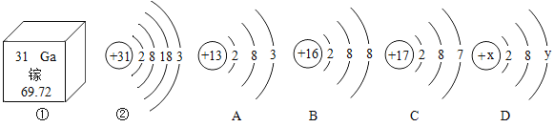
(1)镓元素原子的核电荷数为________,镓原子位于元素周期表中第_________周期。
(2)A、B、C三种粒子所属元素中与镓元素化学性质相似的是______ (填“A”、“B”或“C”),则镓离子与B粒子(B粒子的元素符号为S)形成的化合物的化学式为___________。
(3)如果D为离子结构示意图,则y=____________。如果D为原子结构示意图,则x与y的数量关系为x=____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源,请根据下图回答问题:
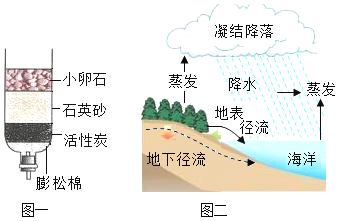
(1)图一是简易净水装置,其中小卵石和石英砂的作用是__________.
(2)图二是自然界水循环示意图,水蒸发过程中不发生变化的是__________(填字母).
A 分子质量 B 分子大小 C 分子间隙
(3)ClO2是一种高效、安全的自来水消毒剂,用化学用语表示该物质中氯元素的化合价________.
(4)同学们用蒸馏的方法得到蒸馏水,用于配置100g溶质质量分数为6.5%的氯化钠溶液,经测定其质量分数偏大,其可能的原因是_________(填字母).
A 氯化钠中有其它可溶性杂质 B 用量筒量取水时,俯视读数
C 砝码生锈 D 蒸发结晶时得到的氯化钠固体不干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com