
科目: 来源: 题型:
【题目】有关空气组成的研究与发现对化学的发展做出了重要贡献。
Ⅰ.拉瓦锡的研究:用加热汞的方法测定空气中氧气的含量如图4所示,拉瓦锡把少量的汞放在密闭的玻璃容器中连续加热12天后,发现有一部分银白色的液态汞变成红色粉末,容器内空气体积减少了约五分之一。收集汞表面生成的红色粉末(氧化汞),置于另一容器内强热得到了汞和氧气,且氧气的体积恰好等于原来密闭容器里所减少的空气体积。

(1)上述实验中,使用汞的优点有______________。
A.汞为液态,在加热的条件下只与氧气反应且生成物为固体
B.时间足够长,能将密闭装置中的氧气几乎耗尽
C.实验过程中没有污染
D.生成的化合物加热分解又能得到汞和氧气
(2)继拉瓦锡研究后,英国科学家瑞利经多次实验发现:从空气分离得到的氮气密度总是略大于纯净氮气密度。造成这一差异主要与空气中的_______________相关。
Ⅱ.兴趣小组A的实验:用红磷燃烧的方法测定空气中氧气的含量(如图5所示)
(3)用酒精灯点燃燃烧匙中过量的红磷,观察到的现象有____________________,并放出大量的热。写出该反应的化学方程式:_____________________________。
(4)该兴趣小组同学经多次实验发现:当反应停止并恢复至室温,用氧气浓度传感器测得广口瓶内始终有8%左右的氧气残留。请分析红磷燃烧无法耗尽氧气的原因是________(已排除操作原因引起的实验误差)。
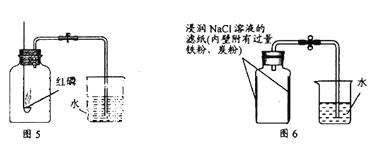
Ⅲ.兴趣小组B的实验:用铁生锈原理测定空气中氧气含量(如图6所示)测得实验数据如下表:

(5)根据表中数据,计算实验测得的空气中氧气的体积分数是___________(计算结果精确到0.1%)。
(6)该实验中NaCl溶液的作用是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁在生产生活中有广泛应用。工业用铁矿石炼铁,实验室也可模拟炼铁。
Ⅰ.工业炼铁
(1)工业炼铁的主要设备为______________。
(2)上述设备中焦炭生成CO的原理为___________(用化学方程式表示)。
(3)某钢铁公司用960万吨含氧化铁60%的赤铁矿炼铁,最多能得到的含杂质4%的生铁多少万吨__________?
Ⅱ.实验室模拟炼铁
(4)实验室模拟炼铁的装置如图1所示。
①写出仪器a的名称_____________。
②澄清石灰水的作用______________________(用化学方程式表示)。
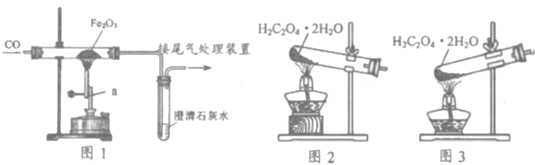
(5)实验室可用加热草酸晶体(H2C2O4·2H2O,熔点为101℃)的方法获得CO。其原理为: ![]() 。用该方法制备CO选用图3所示装置而不选用图2的理由是_______________。
。用该方法制备CO选用图3所示装置而不选用图2的理由是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂从含铜废料中回收铜的生产流程如下.(提示:铜灼烧后的固体可以与稀硫酸反应生成硫酸铜和水;含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水。)

(1)“酸浸”步骤需加热。写出该步骤发生反应的化学方程式____________________。
(2)操作Ⅰ的名称是________,经操作Ⅰ分离所得溶液中含有的微粒有_______(填微粒符号)和H2O。
(3)过量试剂X与操作Ⅰ分离所得溶液发生反应,写出相关的化学方程式:____________。
(4)请补充完整由固体物质Y得到铜粉的实验方案:向固体物质Y中_____________,用水洗涤固体2~3次,干燥得到铜粉。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置常用于实验室制取气体.
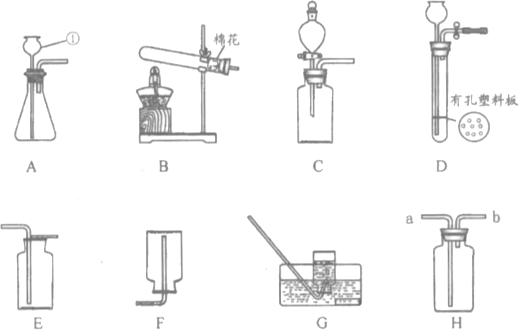
(1)写出上图中指定仪器的名称:①______________。
(2)用高锰酸钾制取并收集纯度相对较大的氧气,可以选择的装置是________(填字母)。该反应的化学方程式为____________________________,属于________(填基本反应类型)反应。
(3)制取二氧化碳时,如需控制产生气体的速率,发生装置最好选用____________(填字母),使用装置H进行排空气法收集二氧化碳,气体应从________(选填“a”或“b”)端通入。
(4)实验室制取硫化氢气体的原理:室温下,块状不溶性的硫化亚铁(FeS)固体与稀硫酸反应(另一产物为硫酸亚铁)。
①写出该反应的化学方程式:___________________。
②若想控制反应的发生和停止,可选用的发生装置为______________(填字母)。
③已知硫化氢气体有毒,密度比空气大,能溶于水且易与NaOH溶液反应。请在下图方框内补充完整收集硫化氢气体的装置图。_______
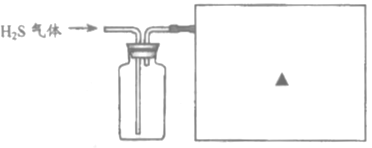
查看答案和解析>>
科目: 来源: 题型:
【题目】回顾学生基础实验“配制50 g溶质质量分数为6%的氯化钠溶液”。
(实验过程)
(1)计算:需要氯化钠的质量为3g,需要水的体积为______________mL。
(2)称取氯化钠:在已调节平衡的天平两端托盘上分别放上质量相等的纸片,用镊子移动游码至刻度如________(选填“甲”或“乙”)图所示。

再用药匙往左盘的纸片上加氯化钠,当发现指针向左偏转时,应该____(填字母)至天平平衡,然后将称好的氯化钠倒入烧杯中。
A.增加氯化钠 B.减少氯化钠 C.增加砝码 D.减少砝码
(3)量取水:先向_______(选填“10 mL”、“50 mL”或“100 mL”)的量筒内倾倒水,当液面接近刻度时改用__________加水至所需刻度。
(4)溶解、转移:用玻璃棒搅拌至氯化钠完全溶解,再将其移入指定容器,贴上标签。
(实验反思)
(5)经检测,某同学配制的氯化钠溶液的溶质质量分数偏小,原因可能是________(填字母)。
A.在左盘放纸片后再调节天平平衡,整个实验过程中右盘都未放纸片
B.将称量完毕的氯化钠转移到烧杯中时,不慎将少量氯化钠洒落在桌面上
C.氯化钠粉末不纯
D.量筒量取水的体积偏大
E.用蒸馏水洗涤烧杯,未经干燥即用来配溶液
F.转移已配好的溶液时,有少量液体溅出
(拓展计算)
(6)列式计算,将所配的50g 6%的氯化钠溶液稀释至0.9%,需加入水的体积_____。 (计算结果精确到0.1 mL)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案的设计中,不能达到实验目的的是
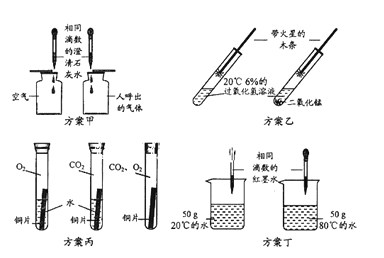
A. 用方案甲比较空气与呼出气体中二氧化碳含量大小
B. 用方案乙研究二氧化锰能加快过氧化氢分解速率
C. 用方案丙研究铜生锈产生铜绿的条件
D. 用方案丁研究温度对微粒运动速率的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组的同学将足量的锌粒加入到浓硫酸中,发现有大量的气泡放出,他们对气体的成分进行了探究。
(提出问题)锌粒加入浓硫酸后生成的气体是什么?
(查阅资料)①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色;
③SO2、CO2与氢氧化钠溶液反应原理相同,且反应前后硫元素化合价不变。
(提出猜想)甲:气体是H2;
乙:气体是:SO2;
丙:气体是_____。
(实验探究)为了验证上述猜想,同学们在老师的指导下设计了如图的装置(部分夹持器材略去,假设每个能发生的反应都完全进行)进行探究:
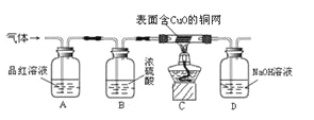
(1)实验开始后,观察到A中品红溶液褪色,证明气体中含有_____。
(2)B装置的作用利用了浓硫酸的_____性。
(3)C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是_____,加热一段时间后,观察到_____的现象,证明气体中含有H2。
(4)D装置的目的是吸收尾气中的SO2,防止造成空气污染。请你写出D瓶中发生反应的化学方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学要配制10g质量分数为16%的氯化钠溶液,步骤如下,请回答下列问题:

(1)用托盘天平称取氯化钠_____g.应选用_____(填10mL、20mL、50mL或100mL)量筒量取所需要的水。
(2)C操作中用到玻璃棒的作用是_____。
(3)某同学实际配制的氯化钠溶液中溶质的质量分数小于16%,可能的原因是_____。
A 量取水时仰视读数
B 称量氯化钠固体时把砝码放在左盘(小于1g的质量移动游码)
C 配制溶液的烧杯用少量蒸馏水润洗
D 把已配好的溶液转移到细口瓶贮存时,有少量溶液溅出
(4)D中所贴标签有不妥之处,你认为在D后的方框中应该写的内容为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】乐乐查间资料发现CaCl2可用作干燥剂。他设计了下面的转换方法,即用CaCO3制得CaCl2.图中“→”表示物质之间的转化关系,“→”上方为反应条件或参与反应的另一种物质。
![]()
(1)A的化学式为:_____;反应③所属的基本反应类型是_____反应;
(2)牛牛认为CaCO3经一步反应就可转化为CaCl2,反应的化学方程式为:_____。
(3)对比两同学的转化方法,我们发现熟练掌握物质的化学性质可以优化物质的转化途径,写出物质B经步转化为CaCO3的化学方程式_____。
(4)现在实验室的老师为乐乐提供了100 g CaCO3,则理论上最多可制得_____g CaCl2固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年3月22日是第二十七届“世界水日”,水与人类的生活和生产密切相关,回答下列问题。
(1)电解水时,与电源负极相连的玻璃管内产生的气体为_____(填名称)。
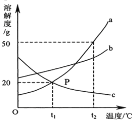
(2)如图为a、b、c三种物质的溶解度曲线。
①t2℃时将30ga物质加入到50g水中,充分溶解,所得溶液的质量为_____。
②温度为_____时,a、c物质的溶解度关系为a>c。
③将t2℃时a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中,溶质的质量分数由大到小为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com