
科目: 来源: 题型:
【题目】如图为实验室常用的制取和收集气体的装置,请回答下列问题。
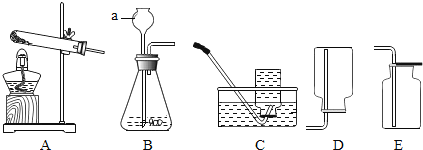
(1)仪器a的名称是_____。
(2)实验室用A装置制备氧气时,反应的化学方程式为_____。为了获得较干燥的氧气,应选用的收集装置是_____(填序号),验满的方法是_____。
(3)实验室制取CO2的化学方程式是_____,发生装置应选用_____(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验示意图回答相关问题。
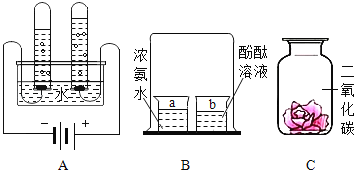
(1)实验A中发生反应的化学方程式为_____。
(2)实验B中的实验现象是_____。
(3)实验C中将紫色石蕊溶液浸泡并晾干的小花,一半喷水后放入集气瓶C中,该实验的目的是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和_____。
(2)天津的解放桥是一座全钢结构可开启的桥梁,它是天津的标志性建筑物之一。
①钢属于_____(填“单质”、“纯净物”或“混合物”)。
②工业上用一氧化碳和赤铁矿炼铁的原理是_____(写化学方程式)。
③建造这座桥大约用了112t铁,理论需要含氧化铁80%的赤铁矿_____t。
(3)为探究铁、铜、银的金属活动性顺序,同学们设计了如图所示的两步实验。
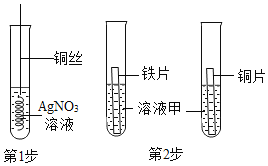
①第1步实验的目的是_____。
②第2步实验中,为了达到实验目的,溶液甲可以是_____(填序号)。
A 稀盐酸 B FeSO4溶液
C CuSO4溶液 D ZnSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】按下列要求完成化学方程式。
(1)硫磺在足量的氧气中燃烧:_____;
(2)将铜丝插入到硝酸银溶液中:_____;
(3)将氧化铁投入到稀硫酸中:_____;
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,溴元素的相关信息如图一所示,回答下列问题:
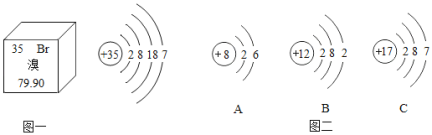
(1)溴的相对原子质量是_____;
(2)溴元素的原子在化学反应中容易_____电子(填“得到”或“失去”),其化学性质与图二中_____(填序号)元素的化学性质相似。
(3)溴元素与图二中B元素形成化合物的化学式是_____。
(4)图二中A元素的原子形成离子,其符号是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色粉末,可能含有氯化铵、氯化钡、碳酸钙、无水硫酸铜、氯化钠、氢氧化钠中的一种或几种。为确定其组成,进行如下实验:
①取少量该粉末置于研钵中研磨,未嗅到任何气味;
②取少量该粉末置于烧杯中,向烧杯中加入适量的水,充分搅拌,静置后,观察到上层溶液呈无色,烧杯底部有蓝白色沉淀,过滤得到滤液和滤渣;
③向上述滤液中滴加几滴硝酸银溶液,溶液变浑浊;
④向上述滤渣中加入足量稀盐酸,充分搅拌,仍有白色沉淀且其质量未减少。下列说法正确的是( )
A.白色粉末中可能有氯化钠和氢氧化钠
B.白色粉末中一定有氯化钡、氢氧化钠、无水硫酸铜
C.白色粉末中一定没有碳酸钙、氢氧化钠、氯化铵,可能有氯化钠
D.白色粉末中一定有氢氧化钠和无水硫酸铜,且二者的质量比可能为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四个图象中,能正确反映对应变化关系的是
A.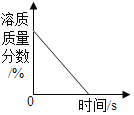 图表示将浓硫酸露置在空气中
图表示将浓硫酸露置在空气中
B.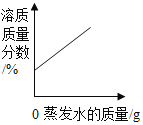 图表示在恒温条件下,将饱和的NaCl溶液蒸发适量水
图表示在恒温条件下,将饱和的NaCl溶液蒸发适量水
C.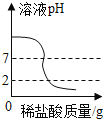 图表示向一定量的氢氧化钠溶液中滴加pH=2的稀盐酸至过量
图表示向一定量的氢氧化钠溶液中滴加pH=2的稀盐酸至过量
D.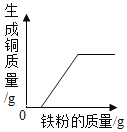 图表示向一定质量的AgNO3和Cu(NO3)2的混合溶液中不断加入铁粉
图表示向一定质量的AgNO3和Cu(NO3)2的混合溶液中不断加入铁粉
查看答案和解析>>
科目: 来源: 题型:
【题目】“侯氏制碱法”是我国著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺。
①生产原理:反应Ⅰ:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:
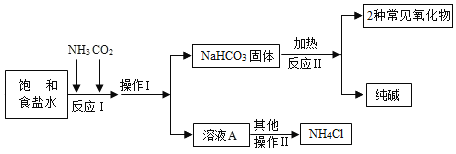
下列叙述错误的是( )
A.生产流程中,操作I的名称是过滤
B.反应I中,涉及的物质氮元素的化合价发生了改变
C.反应I中,碳酸氢钠晶体析出后,剩余的液体中不会含有碳酸氢钠
D.反应Ⅱ的化学方程式是2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应的微观示意图如图,下列说法正确的是( )
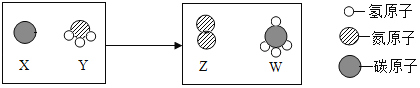
A.Y是由四种原子构成的分子
B.参加反应的X和Y两种物质的质量比为12:17
C.生成的Z和W两种物质的分子个数比为1:1
D.参加反应的Y中氮元素的质量一定等于生成Z的质量
查看答案和解析>>
科目: 来源: 题型:
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。反应化学方程式为: 2CaCO3+O2+2SO2===2CaSO4+2CO2若处理含有1.6 kg二氧化硫的废气,至少需要碳酸钙的质量为________ kg才能将其完全吸收。 | 原煤中含有硫,燃烧时生成的SO2会污染空气。测量SO2含量的化学方程式为:SO2+2H2O+I2=== H2SO4+2HI,取用原煤燃烧产生的工业废气样品1 m3,缓缓通过含碘(I2)1.27 mg的碘溶液,刚好完全反应。则该工业废气中SO2的含量为____mg/m3(假设工业废气中的其它物质不与碘反应)。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com