
| A��1molI2��g����ͨ��1molH2��g������Ӧ����9.48kJ |
| B��1mol��̬����1mol��̬���������������17.00kJ |
| C���ֽ�1molHI��g������H2��g����̬��ķ�Ӧ����13.24kJ |
| D����Ӧ�������ķ�Ӧ���������ȷ�Ӧ�������ķ�Ӧ���������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ڢ� | C���ڢۢ� | D���٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
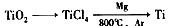
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��C+H2O |
| B��C(s)+H2O(g) |
| C��C(s)+H2O(g) |
D��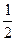 C(s)+ C(s)+ 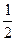 H2O(g) H2O(g)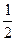 CO(g)+ CO(g)+ 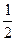 H2(g); ��H=+65.64kJ/mol H2(g); ��H=+65.64kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��




| A��a+b��c |
B��1mol H2O����̬��ΪҺ̬���գ�a-b��kJ���� |
C��������ȼ����Ϊc/2 kJ |
| D��1molH2 O��Һ̬��Ϊ��̬����l c/2-al kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����ʯ�Һ�ˮ�ķ�Ӧ |
| B��̼�Ͷ�����̼��Ӧ |
| C������������������Һ�ķ�Ӧ |
| D��ľ̿��������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢۢ� | B���ڢ� | C���ۢܢ� | D���٢ݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����з�Ӧ����������ڲ�������� |
| B�����жϿ�H-H����������������H-Cl���ų����� |
| C�����жϿ��Ļ�ѧ�����ڷǼ��Լ� |
| D���١��ڡ�����ԭ�ӵ��ȶ��Ծ�ǿ����Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com