
【题目】草酸(H2C2O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验:
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
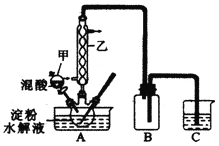
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比为2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是 ______
(2)如何检验该装置的气密性: ______
(3)要控制反应温度55~60℃,应选择加热的方式是 ______,C装置中应加入 ______溶液。
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:______
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
c(mol/L) | V(mL) | c(mol/L) | V(mL) | |||
实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
由此你认为溶液褪色总是先慢后快的原因是 ______
(6)为测定上述实验中得到草酸的纯度,取5.0 g该草酸样品,配制成250 mL溶液,然后取25.00 mL此溶液溶于锥形瓶中,将0.10 mol/L酸性KMnO4溶液装在 ______(填仪器名称)中进行滴定,达到滴定终点时的现象是 ______,若消耗酸性KMnO4溶液体积为20.00 mL,则该草酸样品的纯度为 ______。
【答案】安全瓶(或防止C中液体倒吸进A中) 关闭装置A中分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管中产生一段稳定的水柱,就证明装置气密性良好 水浴加热 NaOH 5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O 生成的Mn2+对此反应起催化剂的作用 酸式滴定管 溶液由无色变为紫色,且半分钟不褪色 ![]()
【解析】
I.淀粉在硫酸存在和加热条件下发生水解反应产生葡萄糖,葡萄糖与浓硝酸发生氧化还原反应产生草酸,同时反应产生NO、NO2气体,装置B为安全瓶,可以防止NO、NO2气体被NaOH溶液吸收时产生的倒吸现象的发生;
II.草酸具有还原性,可以被酸性高锰酸钾溶液氧化为CO2气体,酸性高锰酸钾被还原为无色Mn2+;因此会看到溶液有紫色变为无色,若滴定完全,溶液会变为紫色,半分钟内不褪色;根据对比实验的异同,结合影响化学反应速率的因素分析速率变化的原因;根据仪器的结构、物质的性质判断仪器的使用,根据氧化还原反应中电子守恒计算物质纯度。
(1)反应中生成的NO2、NO能够与NaOH溶液反应生成NaNO2,容易发生倒吸现象,装置B为安全瓶,可以防止C中液体倒吸入反应装置A中;
(2)检验该装置的气密性方法为:关闭A装置中分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管中产生一段稳定的水柱,就证明装置气密性良好;
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热;反应生成的气体为NO2、NO,二者都是有毒气体,需要使用尾气吸收装置,NO2、NO能够与氢氧化钠溶液反应生成NaNO2,所以C中的液体可以为NaOH溶液;
(4)酸性高锰酸钾具有强氧化性,草酸能够被氧化为二氧化碳,导致酸性高锰酸钾溶液褪色,反应的离子方程式为:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O;
(5)通过两组实验比较知,其它条件相同,试验2中加入硫酸锰,其反应时间短,说明反应速率快,从而证明反应生成的Mn2+有催化作用,加快了反应速率;
(6)酸性高锰酸钾溶液具有强氧化性,会腐蚀碱式滴定管的橡胶管,所以不能用碱式滴定管盛放,应该选用酸式滴定管盛放酸性高锰酸钾溶液;滴定过程中,高锰酸根离子完全反应变为Mn2+,溶液为无色,草酸完全反应后,高锰酸根离子过量,使溶液呈紫色,所以滴定终点的现象为:溶液由无色变为紫色,且半分钟不褪色;20 mL0.1 mol/L的高锰酸钾的物质的量n(KMnO4)=c·V=0.1 mol/L×0.02 L=0.002 mol,根据反应55H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O可知,5.0 g该草酸样品中含有草酸的物质的量n(H2C2O4)=0.002 mol×![]() ×
×![]() =0.002 mol×
=0.002 mol×![]() ×
×![]() =0.05 mol,所以该样品中草酸的纯度为:
=0.05 mol,所以该样品中草酸的纯度为:![]() ×100%=90%。
×100%=90%。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO)=0.075mol/(L·min1)
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】泡沫灭火器在灭火时能喷射出大量二氧化碳及泡沫,它们能粘附在可燃物上,使可燃物与空气隔绝,达到灭火的目的。泡沫灭火器内有两个容器,分别盛放两种液体,它们是硫酸铝和碳酸氢钠溶液,两种溶液互不接触,不发生任何化学反应。(平时千万不能碰倒泡沫灭火器)当需要灭火时,把灭火球倒立,两种溶液混合在一起,就会产生大量的二氧化碳气体。
完成下列填空:
①泡沫灭火器的反应_____________________。
②钠和铝的金属性较强的是_______________。
③二氧化碳是_____________化合物。(选填“离子”或“共价”)
④苏打水中含有碳酸氢钠,碳酸氢钠是__________________电解质。(选填“强”或“弱”) 。
⑤硫酸铝溶液呈_____________性(选填“酸”、“碱”或“中”),氢氧化铝受热分解,生成___________和水。
⑥含氢氧化铝的药物可用于治疗胃酸过多,解释其原因_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B. 由于氢键的作用,H2O的稳定性强于H2S
C. 在核电荷数为26的元素原子核外价电子排布图为![]()
D. 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.升温不利于正反应生成Ni(CO)4(g)
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________。
(2)SiF4分子的立体构型为_______形,SiCl4的熔、沸点均高于SiF4,主要原因是________________。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____nm,晶体硅密度的计算表达式为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图装置![]() 铁架台等仪器略
铁架台等仪器略![]() 探究氧化铁与乙醇的反应,并检验反应产物。
探究氧化铁与乙醇的反应,并检验反应产物。
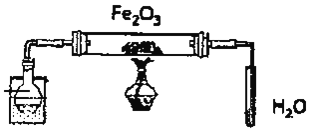
已知:![]() 乙醇的氧化产物是乙醛;
乙醇的氧化产物是乙醛;
![]() 乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
(1)组装好仪器后须进行的操作是______,其方法是______
(2)圆底烧瓶中试剂的结构简式是______。
(3)本实验装置有一处不合理,如不加以改进可能会发生______。
(4)经上述实验,观察至红色的Fe2O3全部变为黑色固体。停止加热,冷却后取出硬质玻璃管中的黑色固体少许许于试管中,再加入足量稀硫酸,振荡,固体全部溶解,得到澄清溶液,实验过程中未观察到气泡产生。澄清溶液中一定含有的金属阳离子是______检验该离子的实验是______
(5)黑色固体成分用FeOx示。用下列装置测量X值。
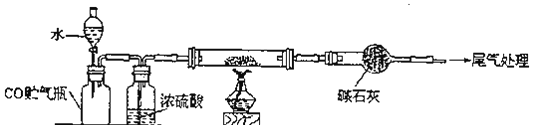
![]() 充分反应后,停止实验的操作是_______
充分反应后,停止实验的操作是_______
![]() 实验中测得数据如下
实验中测得数据如下![]() 进行的反应己完全
进行的反应己完全![]() :
:
空硬质玻璃管的质量56.0g
硬质玻璃管和FeOx的总质量79.2g
硬质玻璃管和Fe粉的总质量72.8g(冷却到室温称量![]()
反应前干燥管及内盛物的总质量48.0g
反应后干燥管及内盛物的总质量65.6g
据上述数据计算出X=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.向FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+
C.向澄清石灰水中通入CO2:2OH-+CO2=CO32-+H2O
D.向稀HNO3溶液中加入少量铜粉:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的价电子排布式为3d64s2;Z原子的![]() 电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2Q3
B.X与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是由极性键构成的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com