
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
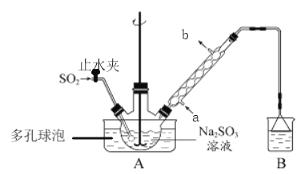
已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上发生分解。
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,将装置A中导气管换成橡皮塞,在80~90℃下,反应约3h,冷却至室温,抽滤将剩余锌粉与难溶性产物除去。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___________(填字母代号);
A.NaOH溶液 B.NaHSO3溶液 C.饱和NaCl溶液
冷凝管中冷却水从___________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是_______________________________________________________。
(3)冷凝管中回流的主要物质除H2O外还有___________(填化学式)。
(4)写出步骤2中发生反应的化学方程式___________________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止_________。
(6)为了测定产品的纯度,准确称取2.0 g样品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.233 g,则所制得的产品的纯度为_____(保留三位有效数字)
【答案】A a 增大气体与溶液的接触面积,加快气体的吸收速率 HCHO NaHSO3+Zn+H2O+HCHO=NaHSO2·HCHO+Zn(OH)2 氧气将产物氧化 38.5%
【解析】
(1)装置B吸收未反应的二氧化硫等,二氧化硫为酸性氧化物,可以用氢氧化钠溶液吸收;根据装置图,采用逆流冷却效果好,冷凝管中冷却水从低处即a口进水。故答案为:A;a;
(2)多孔球泡可以增大气体与溶液的接触面积,加快气体的吸收速率;故答案为:增大气体与溶液的接触面积,加快气体的吸收速率;
(3)甲醛易挥发,为增大产率,需要冷凝回流,故冷凝管中回流的主要物质除H2O外还有HCHO;故答案为:HCHO;
(4)步骤2的反应为制得的NaHSO3与锌粉、甲醛溶液在80~90℃下,生成NaHSO2·HCHO和Zn(OH)2的反应,方程式为:NaHSO3+Zn+H2O+HCHO=NaHSO2·HCHO+Zn(OH)2;
故答案为:NaHSO3+Zn+H2O+HCHO=NaHSO2·HCHO+Zn(OH)2;
(5)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)不稳定,120℃时会分解,故在真空容器中蒸发浓缩可以防止温度过高产物分解,也防止氧气将产物氧化;
故答案为:氧气将产物氧化;
(6)根据反应NaHSO2·HCHO·2H2O+2I2=NaHSO4+HI+HCHO和NaHSO4+BaCl2=BaSO4↓+HCl+NaCl得关系式NaHSO2·HCHO·2H2O~BaCl2,硫酸钡的质量为0.233g,其物质的量为0.001mol,所以样品中纯NaHSO2·HCHO·2H2O的质量为0.001mol×![]() ×154g·mol-1=0.77g,所以纯度=
×154g·mol-1=0.77g,所以纯度=![]() ×100%=38.5%,故答案为:38.5%.
×100%=38.5%,故答案为:38.5%.


科目:高中化学 来源: 题型:
【题目】芳香化合物F是有机化工的重要原料,也可制毒,受公安部管制。
已知:苯环上有烷烃基时,新引入的取代基连在烷烃基的邻对位上;苯环上有羧基时,新引入的取代基连在羧基的间位上。
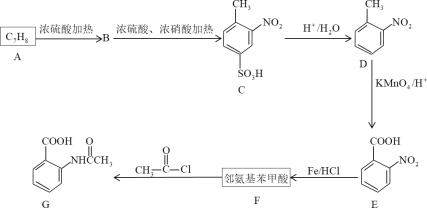
(1)D物质的名称为___,G中官能团的名称为___、___。
(2)A、F的结构简式分别为___、___,E生成F的反应类型是___。
(3)写出A→B产生较多的副产物的结构简式___,该流程未采用甲苯直接硝化的方法制取D,而是经历几步反应才制得D的目的是___。
(4)F在一定条件下能发生聚合反应,请写出其化学反应方程式___。
(5)F的同分异构体中,氨基直接连在苯环上、且能发生银镜反应的芳香族化合物共有___种(不含立体结构)。
(6)请以甲苯为原料,写出合成间氨基苯甲酸的流程图___(无机试剂任选)。合成流程图表示方法示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一个2 L的恒容密闭容器中发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
A. 平衡时,v(A)∶v(B)∶v(C)∶v(D) =4∶3∶2∶1
B. 混合气的平均相对分子质量可作为平衡标志
C. 充入惰性气体使压强增大可加快反应速率
D. C的平均反应速率为0.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:溴苯的熔点为30.8℃,沸点156℃。实验室用苯和液溴制取溴苯的装置如图:
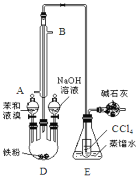
(1)冷凝管的作用___。
(2)E中小试管内CCl4作用___。
(3)用实验证明制取溴苯的反应是取代反应还需添加的试剂是___。
(4)写出图中装有碱石灰的仪器的名称___。
(5)苯与溴还可能发生副反应生成对二溴苯(沸点220℃)和邻二溴苯(沸点224℃),在实验得到的溴苯中还含有二溴苯,可通过___(填分离方法)提纯得到溴苯,写出生成对二溴苯的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是
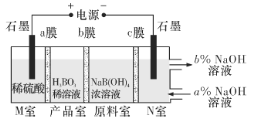
A.M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B.a、c为阳离子交换膜,b为阴离子交换膜
C.N室中:a%<b%
D.理论上每生成1 mol H3BO3,两极室均产生气体,产生气体较少的那一极在标准状况下产生气体的体积约16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是
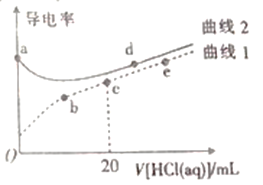
A. 在a、b、c、d、e中,水电离程度最大的点是d
B. c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C. 曲线I中c与e之间某点溶液呈中性
D. a点溶液pH=12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为_________。
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含元素的第一电离能由大到小的顺序为___________,碳原子的轨道杂化类型为_______。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sr3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为___________。
Ⅱ.ZnCl2浓溶液常用于除去金属表面的氧化物,如与FeO反应可得 Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有________(填选项字母)。
A 离子键 B 共价键 C 金属键 D 配位键 E 范德华力 F 氢键
Ⅲ.某微粒的球棍模型如下图所示。
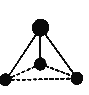
(5)已知含有1个碳原子和3个氢原子,请写出该微粒的化学式:_____。
Ⅳ.铜与氧元素形成的晶胞如下图所示:
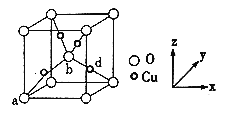
(6)晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为___________,已知该晶体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为___________cm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学釆用离子交换法测定![]() 的溶度积常数。所用离子交换树脂用
的溶度积常数。所用离子交换树脂用![]() 表示(结构如图),交换反应为:
表示(结构如图),交换反应为:![]() 。在
。在![]() 的饱和溶液中还存在平衡:
的饱和溶液中还存在平衡:![]() ,当溶液流经交换树脂时,由于
,当溶液流经交换树脂时,由于![]() 被交换平衡右移,结果溶液中的
被交换平衡右移,结果溶液中的![]() 和
和![]() 中的
中的![]() 全部被交换。下列说法正确的是( )
全部被交换。下列说法正确的是( )
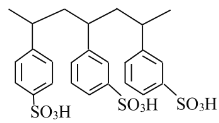
A.用![]() 计测定流出液中
计测定流出液中![]() ,根据交换反应即可求出
,根据交换反应即可求出![]() ,从而计算出
,从而计算出![]() 的溶度积常数
的溶度积常数
B.本实验中,![]()
C.该阳离子交换树脂中有3个手性碳原子
D.为提高交换效果,可加快液体流出速度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com