
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是
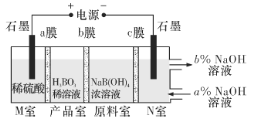
A.M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B.a、c为阳离子交换膜,b为阴离子交换膜
C.N室中:a%<b%
D.理论上每生成1 mol H3BO3,两极室均产生气体,产生气体较少的那一极在标准状况下产生气体的体积约16.8L
【答案】D
【解析】
A.M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-=O2↑+4H+,故A正确;
B.原料室中的B(OH)4-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,原料室中的Na+通过c膜进入N室,则a、c为阳离子交换膜,b为阴离子交换膜,故B正确;
C.电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室:a%<b%,故C正确;
D.理论上每生成1molH3BO3,则M室中就有1mol氢离子通入a膜进入产品室即转移1mole-,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成0.25molO2、N室生成0.5molH2,则两极室共产生标准状况下16.8 L气体,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
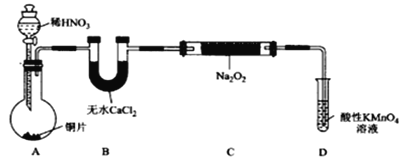
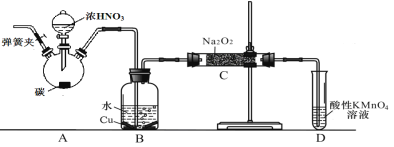
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒。某兴趣小组进行下面实验探究,查阅资料知道:① HNO2为弱酸,② 2NO + Na2O2 = 2NaNO2,③ 2NO2 + Na2O2 = 2NaNO3 ④ 酸性KMnO4溶液可将NO和NO2-均氧化为NO3-,MnO4-还原成Mn2+。NaNO2的制备方法可有如下2种方法(夹持装置和加热装置已略,气密性已检验):
制备装置1:
制备装置2:
(1)在制备装置1中:
①如果没有B装置,C中发生的副反应有_________;
②甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质;于是在A装置与B装置间增加了_____装置,改进后提高了NaNO2的纯度;
③ D装置发生反应的离子方程式为______。
(2)在制备装置2中:
① B装置的作用是_______________________;
②写出装置A烧瓶中发生反应的化学方程式并用单线桥标出电子的转移___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
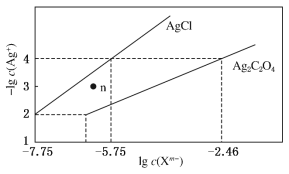
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-![]() I2+I-
I2+I-
B.Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至5
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至5
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1×10-4 mol/L的AgNO3溶液滴入到浓度均为1×10-4 mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积不一定等于10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
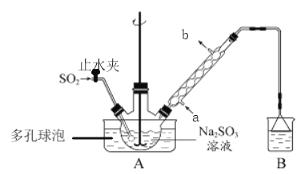
已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上发生分解。
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,将装置A中导气管换成橡皮塞,在80~90℃下,反应约3h,冷却至室温,抽滤将剩余锌粉与难溶性产物除去。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___________(填字母代号);
A.NaOH溶液 B.NaHSO3溶液 C.饱和NaCl溶液
冷凝管中冷却水从___________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是_______________________________________________________。
(3)冷凝管中回流的主要物质除H2O外还有___________(填化学式)。
(4)写出步骤2中发生反应的化学方程式___________________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止_________。
(6)为了测定产品的纯度,准确称取2.0 g样品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.233 g,则所制得的产品的纯度为_____(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
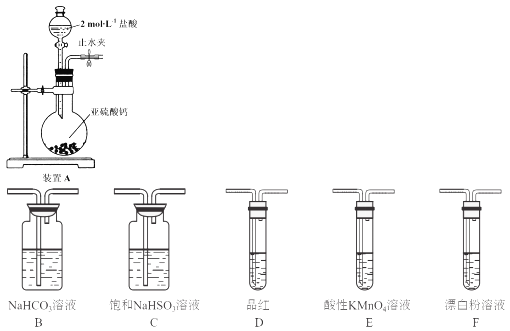
(1)装置A中反应的化学方程式为___________。
(2)使分液漏斗中液体顺利流下的操作是___________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___________。
②丙同学设计的合理实验方案为:A→C→_____→___→D→F,其中装置C的作用是_____,证明亚硫酸的酸性强于次氯酸的实验现象是____。
(4)K2S2O3具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_____。称取0.2500g产品于碘量瓶中,加100mL水溶解,再加入8.000g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用cmol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液VmL,则样品中K2S2O8的纯度为______%(用含c、V的代数式表示,已知:S2O82-+2I-=2SO42-+I2;2S2O32-+I2=S4O62-+2I-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
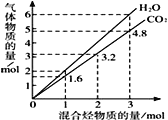
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈及其化合物在工业生产中应用广泛。以某玻璃废料(主要成分为CeO2、SiO2、Fe2O3、FeO等)为原料制备CeO2和NH4Fe(SO4)2·12H2O(硫酸铁铵晶体),其流程如下(已知CeO2既不溶于稀硫酸,也不溶于氢氧化钠溶液):
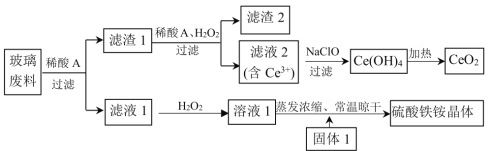
回答下列问题:
(1)浸取玻璃废料选用的“稀酸A”为____________(填“稀硫酸”或“稀盐酸”)。
(2)向滤渣1加入H2O2的目的是_________(用离子方程式表示)。为了提高溶解“滤渣1”的速率,常釆用加热措施,但温度高于60℃时溶解速率减慢,其主要原因是____________。
(3)为了不引入杂质,所选用固体1的化学式为_______________。
(4)制备2mol CeO2需要NaClO的质量为____________。
(5)锌铈液流电池放电时的工作原理如图所示。
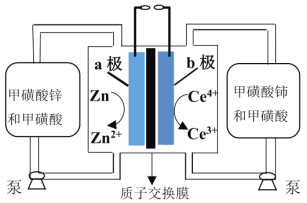
①放电时电池的总离子反应方程式为____________________。
②充电时,当a极增重6.5g时,有_________mol离子通过交换膜以平衡电荷。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com