
【题目】下列物质能导电的是( )
A.液态氯化氢B.盐酸
C.食盐晶体D.蔗糖
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fex(OH)y(SO4)z](铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL的溶液。②准确量取25.00 mL溶液,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体6.99g。③准确量取25.00mL溶液,加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥、灼烧至恒重,得到红棕色固体1.92g。该聚合硫酸铁组成中x∶y∶z的值为
A. 6∶8∶5 B. 4∶2∶5 C. 1∶1∶2 D. 6∶3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。( )

![]()
下列说法不正确的是 ( )
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,5-CFDA消耗的NaOH 物质的量多
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种优良的消毒剂,常用于自来水的消毒。已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2。
(1)工业上常将ClO2制备成NaClO2固体以便运输和贮存,流程如下:

①吸收器中,H2O2的作用是____。(填“氧化剂”或“还原剂”)。
②在吸收器反应时应控制温度低于5℃的原因是:____。
③操作a:55℃蒸发至有大量晶体析出、____、用介于38℃~60℃的温水洗涤、低于60℃干燥,得到NaClO2固体。
(2)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1:取待测ClO2溶液20.00mL于锥形瓶中;
步骤2:用稀H2SO4调节溶液pH <2.0,加入足量的KI晶体充分反应;
步骤3:加入几滴淀粉溶液,逐滴加入0.1 mol· L-1的Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液20.00mL;
已知:2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI,试计算溶液中ClO2的物质的量浓度(写出计算过程)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:

(1)写出反应1的离子方程式___________。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。

①比较a、b点的反应速率:va逆_______vb正(填或“>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______(填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____(保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH2
ΔH=_____。(含ΔH1、ΔH2的代数式)
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。
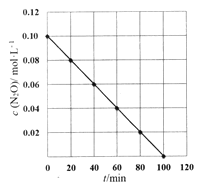
己知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________,n=_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂不仅是营养物质和主要食物,也是一种重要的工业原料。下面是以油脂为主要原料获得部分产品的合成路线:

己知:①G (C10H10O4)分子中的官能团处于对位;
②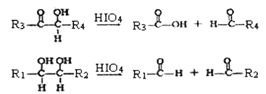
(R1、R2、R3与R4可能是氢、烃基或其他基团)
回答下列问题:
(1)下列关于油脂的说法正确的是____。(填标号)
a.油脂包括植物油和脂肪,属于酯类
b.天然油脂是混合甘油酯组成的混合物,无固定的熔点和沸点
c.油脂属天然高分子化合物,许多油脂兼有烯烃的化学性质
d.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
(2)G中官能团的名称为______,反应①的反应类型为_________。
(3)用系统命名法写出F的名称___________。
(4)在酸催化下物质的量的B与苯酚反应生成一种线型结构高分子的化学方程式为______________________。
(5)二元取代芳香化合物H是G的同分异构体,H满足下列条件:
①能发生银镜反应
②酸性条件下水解产物物质的量之比为2:1
③不与NaHCO3溶液反应。
则符合上述条件的H共有______种(不考虑立体结构,不包含G本身)。其中核磁共振氢谱为五组峰的结构简式为________(写出一种即可)。
(6)写出从HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)
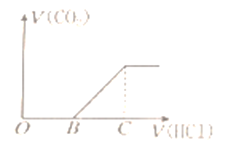
A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com