
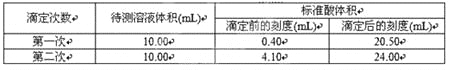
ΓΨΧβΡΩΓΩΘ®1Θ©50 mL 0.50 mol/L―ΈΥα”κ50 mL 0.55 mol/L NaOH»ή“Κ‘Ύ»γΆΦΥυ ΨΒΡΉΑ÷Ο÷–Ϋχ––÷–ΚΆΖ¥”ΠΓΘΆ®Ιΐ≤βΕ®Ζ¥”ΠΙΐ≥Χ÷–ΥυΖ≈≥ωΒΡ»»ΝΩΩ…ΦΤΥψ÷–ΚΆ»»Θ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ

ΔΌ¥” Β―ιΉΑ÷Ο…œΩ¥Θ§ΆΦ÷–…–»±…ΌΒΡ“Μ÷÷≤ΘΝß”ΟΤΖ «______ΓΘ
ΔΎ¥σ…’±≠…œ»γ≤ΜΗ«”≤÷ΫΑεΘ§«σΒΟΒΡ÷–ΚΆ»» ΐ÷ΒΫΪ________ (ΧνΓΑ ΤΪ¥σΓ±ΓΑΤΪ–ΓΓ±ΜρΓΑΈό”ΑœλΓ±)ΓΘ
Θ®2Θ©ΥαΦν÷–ΚΆΒΈΕ® «÷–―ßΜ·―ß≥ΘΦϊ Β―ιΓΘ
Ρ≥―ß–ΘΜ·―ßΩΈΆβ–ΓΉι”Ο0.2000 molΓΛL-1―ΈΥαΒΈΕ®Έ¥÷Σ≈®Ε»ΒΡ«β―θΜ·ΡΤ»ή“ΚΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΓΘ
ΔΌΒΈΕ®Ιΐ≥Χ÷–Θ§―έΨΠ”ΠΉΔ ”_____________________________________ΓΘ
ΔΎ‘ΎΧζΦήΧ®…œΒφ“Μ’≈ΑΉ÷ΫΘ§ΤδΡΩΒΡ «_____________________________ΓΘ
ΔέΗυΨίœ¬±μ ΐΨίΘ§ΦΤΥψ±Μ≤β…’Φν»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε» «____molΓΛLΘ≠1ΓΘΘ®±ΘΝτΥΡΈΜ”––ß ΐΉ÷Θ©
Δήœ¬Ν– Β―ι≤ΌΉςΕ‘ΒΈΕ®ΫαΙϊ≤ζ…ζ ≤Ο¥”Αœλ(ΧνΓΑΤΪΗΏΓ±ΓΔΓΑΤΪΒΆΓ±ΜρΓΑΈό”ΑœλΓ±)?
a.Ιέ≤λΥα ΫΒΈΕ®Ιή“ΚΟφ ±Θ§ΩΣ ΦΗ© ”Θ§ΒΈΕ®÷’ΒψΤΫ ”Θ§‘ρΒΈΕ®ΫαΙϊ________ΓΘ
b.»τΫΪΉΕ–ΈΤΩ”Ο¥ΐ≤β“Κ»σœ¥Θ§»ΜΚσ‘ΌΦ”»κ10.00 mL¥ΐ≤β“ΚΘ§‘ρΒΈΕ®ΫαΙϊ_______ΓΘ
ΓΨ¥πΑΗΓΩΜΖ–Έ≤ΘΝßΫΝΑηΑτ ΤΪ–Γ ΉΕ–ΈΤΩΡΎ»ή“Κ―’…ΪΒΡ±δΜ· ±ψ”ΎΙέ≤λΉΕ–ΈΤΩΡΎ“ΚΧε―’…ΪΒΡ±δΜ·Θ§Φθ–ΓΒΈΕ®Έσ≤ν 0.4000 ΤΪΗΏ ΤΪΗΏ
ΓΨΫβΈωΓΩ
Θ®1Θ©ΔΌ Β―ι÷––η“ΣΫΝΑηΘ§Υυ“‘¥” Β―ιΉΑ÷Ο…œΩ¥Θ§ΆΦ÷–…–»±…ΌΒΡ“Μ÷÷≤ΘΝß”ΟΤΖ «ΜΖ–Έ≤ΘΝßΫΝΑηΑτΓΘ
ΔΎ¥σ…’±≠…œ»γ≤ΜΗ«”≤÷ΫΑεΘ§‘ρΜα‘λ≥…»»ΝΩΒΡΥπ ßΘ§‘ρ«σΒΟΒΡ÷–ΚΆ»» ΐ÷ΒΫΪΤΪ–ΓΓΘ
Θ®2Θ©ΔΌΒΈΕ®Ιΐ≥Χ÷–Θ§―έΨΠ”ΠΉΔ ”ΉΕ–ΈΤΩΡΎ»ή“Κ―’…ΪΒΡ±δΜ·ΓΘ
ΔΎ‘ΎΧζΦήΧ®…œΒφ“Μ’≈ΑΉ÷ΫΘ§ΤδΡΩΒΡ «±ψ”ΎΙέ≤λΉΕ–ΈΤΩΡΎ“ΚΧε―’…ΪΒΡ±δΜ·Θ§Φθ–ΓΒΈΕ®Έσ≤νΓΘ
ΔέΗυΨί±μ÷–ΒΡ ΐΨίΩ…÷ΣΘ§ΝΫ¥Έ Β―ι÷–œϊΚΡ―ΈΥαΒΡΧεΜΐ «20.10mlΚΆ19.90mlΘ§‘ρœϊΚΡ―ΈΥαΧεΜΐΒΡΤΫΨυ÷Β «20.00mlΘ§Υυ“‘…’Φν»ή“ΚΒΡ≈®Ε» «![]() ΘΫ0.4000mol/LΓΘ
ΘΫ0.4000mol/LΓΘ
ΔήΙέ≤λΥα ΫΒΈΕ®Ιή“ΚΟφ ±Θ§ΩΣ ΦΗ© ”Θ§ΒΈΕ®÷’ΒψΤΫ ”ΓΘ”…”ΎΗ© ”ΕΝ ΐΤΪ–ΓΘ§Υυ“‘‘ρΒΈΕ®ΫαΙϊΤΪΗΏΘΜ»τΫΪΉΕ–ΈΤΩ”Ο¥ΐ≤β“Κ»σœ¥Θ§»ΜΚσ‘ΌΦ”»κ10.00 mL¥ΐ≤β“ΚΘ§‘ρœϊΚΡ―ΈΥαΒΡΧεΜΐ‘ωΦ”Θ§Υυ“‘ΒΈΕ®ΫαΙϊΤΪΗΏΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬œρ10mL0.1mol/LNaOH»ή“Κ÷–Φ”»κ0.1mol/LΒΡ“Μ‘ΣΥαHAΘ§»ή“ΚpHΒΡ±δΜ·«ζœΏ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

A.aΒψ»ή“Κ÷–ΘΚc(Na+)>c(A-)>c(H+)>c(HA)
B.aΓΔcΝΫΒψ»ή“Κ÷–Υ°ΒΡΒγάκ≥ΧΕ»œύΆ§
C.bΒψ»ή“Κ÷–ΘΚc(Na+)=c(A-)+c(HA)
D.cΒψ»ή“Κ÷–ΘΚc(A-)>c(HA)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®Μ·―ß“Μ―Γ–ό3:Έο÷ ΫαΙΙ”κ–‘÷ Θ©
Κ§≈πΓΔΒΣΓΔΝΉΒΡΜ·ΚœΈο”––μΕύ÷Ί“Σ”ΟΆΨΘ§»γ:(CH3)3NΓΔCu3PΓΔΝΉΜ·≈πΒ»ΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)ΜυΧ§B‘≠Ή”ΒγΉ”’ΦΨίΉνΗΏΡήΦΕΒΡΒγΉ”‘Τ¬÷άΣΆΦΈΣ________ΘΜΜυΧ§Cu+ΒΡΚΥΆβΒγΉ”≈≈≤Φ ΫΈΣ___________ΓΘ
(2)Μ·ΚœΈο(CH3)3NΖ÷Ή”÷–N‘≠Ή”‘”Μ·ΖΫ ΫΈΣ________Θ§ΗΟΈο÷ Ρή»ή”ΎΥ°ΒΡ‘≠“ρ «______ΓΘ
(3)PH3Ζ÷Ή”ΒΡΦϋΫ«–Γ”ΎNH3Ζ÷Ή”ΒΡ‘≠“ρ «________________ΘΜ―«ΝΉΥα(H3PO3) «ΝΉ‘ΣΥΊΒΡ“Μ÷÷Κ§―θΥαΘ§”κNaOHΖ¥”Π÷Μ…ζ≥…NaH2PO3ΚΆNa2HPO3ΝΫ÷÷―ΈΘ§‘ρH3PO3Ζ÷Ή”ΒΡΫαΙΙ ΫΈΣ______________________ΓΘ
(4)ΝΉΜ·≈π «“Μ÷÷ΡΆΡΞΆΩΝœΘ§ΥϋΩ…”ΟΉςΫπ τΒΡ±μΟφ±ΘΜΛ≤ψΓΘΝΉΜ·≈πΨßΧεΨßΑϊ»γΆΦΥυ ΨΘΚ

ΔΌ‘Ύ“ΜΗωΨßΑϊ÷–‘≠Ή”ΒΡ≈δΈΜ ΐΈΣ_______________ΓΘ
ΔΎ“―÷ΣΝΉΜ·≈πΨßΧεΒΡΟήΕ»ΈΣpg/cm3Θ§ΑΔΖϋΦ”Β¬¬ό≥Θ ΐΈΣNAΘ§‘ρB-PΦϋ≥ΛΈΣ_________ΓΘ
ΔέΝΉΜ·≈πΨßΑϊ―ΊΉ≈ΧεΕ‘Ϋ«œΏΖΫœρΒΡΆΕ”Α»γΆΦΘ§«κ‘Ύ¥πΧβΩ®…œΫΪ±μ ΨB‘≠Ή”ΒΡ‘≤»ΠΆΩΚΎ_________ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§œρ 2.0 LΚψ»ίΟή±’»ίΤς÷–≥δ»κ1.0 mol PCl5Θ§Ζ¥”ΠPCl5(g)PCl3(g)ΘΪCl2(g)Ψ≠Ιΐ“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΓΘΖ¥”ΠΙΐ≥Χ÷–≤βΕ®ΒΡ≤ΩΖ÷ ΐΨίΦϊœ¬±μΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.Ζ¥”Π‘Ύ«Α 50 s ΒΡΤΫΨυΥΌ¬ v(PCl3)ΘΫ0.0032 molΓΛL1ΓΛs1
B.ΗΟΧθΦΰœ¬Θ§Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐK=0.05
C.±Θ≥÷ΤδΥϊΧθΦΰ≤Μ±δΘ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβ ±c(PCl3)ΘΫ0.11 molΓΛL1Θ§‘ρΖ¥”ΠΒΡΠΛHΘΦ0
D.ΤδΥϊΧθΦΰœύΆ§ ±Θ§œρΩ’ΒΡ»ίΤς÷–≥δ»κ1.0 mol PCl5ΓΔ0.20 mol PCl3ΚΆ0.20 mol Cl2Θ§¥Υ ± v(’ΐ)ΘΨv(Ρφ)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œρ20 mL 0.1 molΓΛL1ΒΡHA»ή“Κ÷–÷πΒΈΦ”»κ0.1molΓΛL1ΒΡNaOH»ή“ΚΘ§»ή“Κ÷–Υ°ΥυΒγάκΒΡcΥ°(HΘΪ)ΥφΦ”»κNaOH»ή“ΚΧεΜΐΒΡ±δΜ·»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
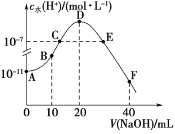
A.HAΒΡΒγάκ≥Θ ΐKa‘ΦΈΣ1ΓΝ105
B.BΒψΒΡ»ή“Κ÷–ΝΘΉ”≈®Ε»¬ζΉψΙΊœΒΘΚc(HA)ΘΨc(NaΘΪ)ΘΨc(A)
C.CΓΔEΝΫΒψ“ρΈΣΕ‘Υ°ΒΡΒγάκΒΡ“÷÷ΤΉς”ΟΚΆ¥ΌΫχΉς”ΟœύΆ§Θ§Υυ“‘»ή“ΚΨυ≥ ÷––‘
D.FΒψΒΡ»ή“Κ≥ Φν–‘Θ§ΝΘΉ”≈®Ε»¬ζΉψΙΊœΒc(OH)ΘΫc(HA)ΘΪc(A)ΘΪc(HΘΪ)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
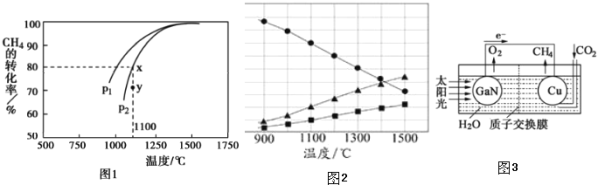
ΓΨΧβΡΩΓΩΥΡ¬»Μ·Έΐ≥Θ”ΟΉςΟΫ»ΨΦΝΓΔ”–ΜζΚœ≥…÷–ΒΡ¥ΏΜ·ΦΝΘ§“―÷ΣSnCl4“ΉΥ°ΫβΘ§»ήΒψΈΣ-33ΓφΓΔΖ–ΒγΈΣ114ΓφΓΘΡ≥―–ΨΩ–‘―ßœΑ–ΓΉι…ηΦΤ»γΆΦΉΑ÷Ο(≤ΩΖ÷Φ–≥÷ΉΑ÷ΟΦΑΦ”»»“«Τς Γ¬‘)÷Τ±ΗSnCl4ΓΘ
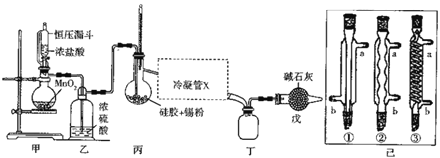
Θ®1Θ©ΉΑ÷ΟΦΉ÷–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___ΓΘ’ϊΗω÷Τ±ΗΉΑ÷Ο÷–”–“Μ¥Π≤ΜΉψΘ§ΗΡΫχΒΡΖΫΖ® «___ΓΘ
Θ®2Θ©άϊ”ΟΗΡΫχΚσΒΡΉΑ÷ΟΫχ–– Β―ι(œ¬Ά§) ±ΦΉΓΔ±ϊΨυ–ηΦ”»»Θ§ Ήœ»Φ”»»ΒΡ «___¥ΠΒΡ…’ΤΩΘ§άδΡΐΙήx «“―÷–ΒΡ“Μ÷÷Θ§ΗΟ“«ΤςΒΡ±ύΚ≈ «___Θ§ΉΑ÷ΟΈλΒΡ”ΟΆΨ «___ΓΘ
Θ®3Θ© Β―ιΙΐ≥Χ÷–ΉΑ÷ΟΦΉ÷–≥ΐΙέ≤λΒΫΙΧΧε»ήΫβΆβΘ§ΜΙΩ…Ιέ≤λΒΫΒΡΟςœ‘±δΜ· «___ΓΘ
Θ®4Θ©ΗΟ–ΓΉιΒΡΦΉΆ§―ßΧα≥ωΘ§Ω…άϊ”Ο±ξΉΦNaOH»ή“ΚΒΈΕ®ΦΉ÷– Θ”ύ»ή“ΚΒΡΖΫΖ®≤βΕ®≥ω―ΈΥα”κMnO2Ζ¥”ΠΒΡΉνΒΆ≈®Ε»ΓΘ
ΔΌΒΈΕ® ±Υυ”Ο÷Η ΨΦΝΉνΚΟ «___[ΦΌ…ηΩΣ Φ≥ωœ÷Mn(OH)2Θ§≥ΝΒμ ±ΒΡpH‘ΦΈΣ6.8]ΓΘ
ΔΎΦΌ…η Β―ι ±¥”ΦΉ÷–ΉΦ»Ζ»Γ≥ωV2 mL³è”ύ»ή“Κ≤ΔœΓ ΆΒΫV3mLΘ§»ΜΚσ”Ο0.1000molL-1ΒΡ NaOH»ή“ΚΫχ––ΒΈΕ®Θ§ΒΈΕ®÷’Βψ ±œϊΚΡΒτV1 mLNaOH»ή“ΚΘ§‘ρ―ΈΥα”κMnO2Ζ¥”Π ±ΉνΒΆ≈®Ε»”Π¥σ”Ύ___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΧΫΨΩNa2SO3 »ή“ΚΚΆΗθ(VI)―Έ»ή“ΚΒΡΖ¥”ΠΙφ¬…Θ§Ρ≥–ΓΉιΆ§―ßΫχ–– Β―ι»γœ¬ΘΚ “―÷ΣΘΚ![]() (≥»…Ϊ)+ H2O
(≥»…Ϊ)+ H2O![]() (ΜΤ…Ϊ)+ 2H+
(ΜΤ…Ϊ)+ 2H+
(1)≈δ÷Τ»ή“Κ
–ρΚ≈ | ≤ΌΉς | œ÷œσ |
i | ≈δ÷Τ±ΞΚΆNa2SO3 »ή“ΚΘ§≤β»ή“ΚΒΡpH | pH ‘ΦΈΣ 9 |
ii | ≈δ÷Τ0.05 molΓΛL1 ΒΡK2Cr2O7»ή“ΚΘ§Α―»ή“ΚΤΫΨυΖ÷≥…ΝΫΖίΘ§œρΝΫΖί»ή“Κ÷–Ζ÷±πΒΈΦ”≈®ΝρΥαΚΆ≈® KOH »ή“ΚΘ§ΒΟΒΫpH=2 ΒΡ»ή“ΚA ΚΆ pH=8 ΒΡ»ή“ΚB | pH=2ΒΡ»ή“ΚA ≥ ≥»…ΪΘΜpH=8ΒΡ»ή“Κ B ≥ ΜΤ…Ϊ |
ΔΌ ”ΟΜ·―ß”Ο”ο±μ Ψ±ΞΚΆ Na2SO3 »ή“Κ pH ‘ΦΈΣ 9 ΒΡ‘≠“ρΘΚ__ΓΘ
(2)Ϋχ–– Β―ιiii ΚΆ ivΘΚ
–ρΚ≈ | ≤ΌΉς | œ÷œσ |
iii | œρ 2 mL »ή“Κ A ÷–ΒΈΦ” 3 ΒΈ±ΞΚΆ Na2SO3 »ή“Κ | »ή“Κ±δ¬Χ…Ϊ(Κ§Cr3+) |
iv | œρ 2 mL »ή“Κ B ÷–ΒΈΦ” 3 ΒΈ±ΞΚΆ Na2SO3 »ή“Κ | »ή“ΚΟΜ”–Οςœ‘±δΜ· |
ΔΎ ”ΟάκΉ”ΖΫ≥Χ ΫΫβ Ά iii ÷–œ÷œσΘΚ__ΓΘ
(3)ΦΧ–χΫχ–– Β―ιvΘΚ
–ρΚ≈ | ≤ΌΉς | œ÷œσ |
v | œρ 2 mL ±ΞΚΆ Na2SO3 »ή“Κ÷–ΒΈΦ” 3 ΒΈ»ή“ΚA | »ή“Κ±δΜΤ…Ϊ |
vi | œρ 2 mL ’τΝσΥ°÷–ΒΈΦ” 3 ΒΈ»ή“ΚA | »ή“Κ±δ«≥≥»…Ϊ |
Δέ Β―ι vi ΒΡΡΩΒΡ «__ΓΘ
Δή ”ΟΜ·―ßΤΫΚβ“ΤΕ·‘≠άμΫβ Ά v ÷–œ÷œσΘΚ__ΓΘ
Δί ΗυΨί Β―ιiiiΓΪvΘ§Ω…ΆΤ≤βΘΚNa2SO3 »ή“ΚΚΆΗθ(VI)―Έ»ή“ΚΒΡΖ¥”Π”κ»ή“ΚΥαΦν–‘”–ΙΊΘ§__ΓΘ
Δό œρ Β―ι v ΥυΒΟΜΤ…Ϊ»ή“Κ÷–ΒΈΦ”__Θ§≤ζ…ζΒΡœ÷œσ÷Λ ΒΝΥ…œ ωΆΤ≤βΓΘ
(4)ΦΧ–χΧΫΨΩ»ή“ΚΥα–‘‘ω«ΩΕ‘Ηθ(VI)―Έ»ή“Κ―θΜ·–‘ΒΡ”ΑœλΘ§ΗΟΆ§―ßάϊ”Ο»γΆΦΉΑ÷ΟΦΧ–χ Β―ι(“―÷ΣΒγ―Ι¥σ–ΓΖ¥”≥ΝΥΈο÷ ―θΜ·ΜΙ‘≠–‘«Ω»θΒΡ≤ν“λΘΜΈο÷ ―θΜ·–‘”κΜΙ‘≠–‘«Ω»θ≤ν“λ‘Ϋ¥σΘ§Βγ―Ι‘Ϋ¥σ)ΓΘ
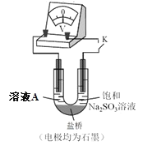
a.K ±’Κœ ±Θ§Βγ―ΙΈΣaΓΘ
b.œρU –ΆΙήΉσ≤ύ»ή“Κ÷–ΒΈΦ” 3 ΒΈ≈®ΝρΥαΚσΘ§Βγ―Ι‘ω¥σΝΥbΓΘ
ΔΏ …œ ω Β―ιΥΒΟςΘΚ__ΓΘ
Δύ ”–Ά§―ß»œΈΣΘΚΥφ»ή“ΚΥα–‘‘ω«ΩΘ§»ή“Κ÷–O2 ΒΡ―θΜ·–‘‘ω«Ω“≤Μα ΙΒγ―Ι‘ω¥σΓΘάϊ”Ο»γΆΦΉΑ÷Ο―Γ‘ώΚœ ‘ΦΝΫχ–– Β―ιΘ§ΫαΙϊ±μΟςO2 ΒΡ¥φ‘Ύ≤Μ”Αœλ…œ ωΫα¬έΓΘΗΟ Β―ιΖΫΑΗ «__Θ§≤βΒΟΒγ―Ι‘ω¥σΝΥ d(d < b)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§Ζ¥”ΠA(g)ΘΪB(g) ![]() C(g)(’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”Π)¥οΒΫΤΫΚβΚσΘ§ΗυΨίœ¬Ν–ΆΦœώ≈–ΕœΘΚ
C(g)(’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”Π)¥οΒΫΤΫΚβΚσΘ§ΗυΨίœ¬Ν–ΆΦœώ≈–ΕœΘΚ
(1)…ΐΈ¬Θ§¥οΒΫ–¬ΤΫΚβΒΡ «________Θ§–¬ΤΫΚβ÷–CΒΡΧεΜΐΖ÷ ΐ________(ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±Θ§œ¬Ά§)ΓΘ
(2)ΫΒ―ΙΘ§¥οΒΫ–¬ΤΫΚβΒΡ «________Θ§AΒΡΉΣΜ·¬ ________ΓΘ
(3)Φθ…ΌCΒΡΝΩΘ§¥οΒΫ–¬ΤΫΚβΒΡ «_______ΓΘ
(4)‘ωΦ”AΒΡΝΩΘ§¥οΒΫ–¬ΤΫΚβΒΡ «____Θ§¥Υ ±BΒΡΉΣΜ·¬ ________Θ§AΒΡΉΣΜ·¬ ________ΓΘ
(5) Ι”Ο¥ΏΜ·ΦΝΘ§¥οΒΫΤΫΚβΒΡ «________Θ§ CΒΡ÷ ΝΩΖ÷ ΐ________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧλ»ΜΤχ «“Μ÷÷÷Ί“ΣΒΡ«εΫύΡή‘¥ΚΆΜ·ΙΛ‘≠ΝœΘ§Τδ÷ς“Σ≥…Ζ÷ΈΣΦΉΆιΓΘ
![]() “―÷ΣΘΚ
“―÷ΣΘΚ![]() ,‘ρΖ¥”Π
,‘ρΖ¥”Π![]() ______ ΓΘ
______ ΓΘ
![]() Χλ»ΜΤχΒΡ“ΜΗω÷Ί“Σ”ΟΆΨ «÷Τ»Γ
Χλ»ΜΤχΒΡ“ΜΗω÷Ί“Σ”ΟΆΨ «÷Τ»Γ![]() Θ§Τδ‘≠άμΈΣΘΚ
Θ§Τδ‘≠άμΈΣΘΚ![]() ΓΘ“ΜΕ®ΧθΦΰœ¬Θ§‘ΎΟή±’»ίΤς÷–Θ§Ά®»κΈο÷ ΒΡΝΩ≈®Ε»ΨυΈΣ
ΓΘ“ΜΕ®ΧθΦΰœ¬Θ§‘ΎΟή±’»ίΤς÷–Θ§Ά®»κΈο÷ ΒΡΝΩ≈®Ε»ΨυΈΣ![]() ΒΡ
ΒΡ![]() ”κ
”κ![]() Θ§‘ΎΖΔ…ζΖ¥”Π ±Θ§≤βΒΟ
Θ§‘ΎΖΔ…ζΖ¥”Π ±Θ§≤βΒΟ![]() ΒΡΤΫΚβΉΣΜ·¬ ”κΈ¬Ε»ΦΑ―Ι«ΩΒΡΙΊœΒ»γΆΦ1Υυ ΨΘ§
ΒΡΤΫΚβΉΣΜ·¬ ”κΈ¬Ε»ΦΑ―Ι«ΩΒΡΙΊœΒ»γΆΦ1Υυ ΨΘ§
![]() ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫΈΣ______ ΓΘ
ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫΈΣ______ ΓΘ
![]() ―Ι«Ω
―Ι«Ω![]() ______
______ ![]() ΧνΓΑ¥σ”ΎΓ±ΜρΓΑ–Γ”ΎΓ±
ΧνΓΑ¥σ”ΎΓ±ΜρΓΑ–Γ”ΎΓ±![]() ΘΜ―Ι«ΩΈΣ
ΘΜ―Ι«ΩΈΣ![]() ±Θ§‘ΎYΒψΘΚ
±Θ§‘ΎYΒψΘΚ![]() ’ΐ
’ΐ![]() ______
______ ![]() Ρφ
Ρφ![]() ΧνΓΑ¥σ”ΎΓΑΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓΑ
ΧνΓΑ¥σ”ΎΓΑΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓΑ![]() ΓΘ
ΓΘ
![]() Χλ»ΜΤχ÷–ΒΡ…ΌΝΩ
Χλ»ΜΤχ÷–ΒΡ…ΌΝΩ![]() ‘”÷ ≥Θ”ΟΑ±Υ°Έϋ ’Θ§≤ζΈοΈΣ
‘”÷ ≥Θ”ΟΑ±Υ°Έϋ ’Θ§≤ζΈοΈΣ![]() ΓΘ“ΜΕ®ΧθΦΰœ¬œρ
ΓΘ“ΜΕ®ΧθΦΰœ¬œρ![]() »ή“Κ÷–Ά®»κΩ’ΤχΘ§ΒΟΒΫΒΞ÷ Νρ≤Δ ΙΈϋ ’“Κ‘Ό…ζΘ§–¥≥ω‘Ό…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ ΓΘ
»ή“Κ÷–Ά®»κΩ’ΤχΘ§ΒΟΒΫΒΞ÷ Νρ≤Δ ΙΈϋ ’“Κ‘Ό…ζΘ§–¥≥ω‘Ό…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ ΓΘ
![]() ΙΛ“Β…œ”÷≥ΘΫΪ¥”Χλ»ΜΤχΖ÷άκ≥ωΒΡ
ΙΛ“Β…œ”÷≥ΘΫΪ¥”Χλ»ΜΤχΖ÷άκ≥ωΒΡ![]() Θ§‘ΎΗΏΈ¬œ¬Ζ÷Ϋβ…ζ≥…Νρ’τΤχΚΆ
Θ§‘ΎΗΏΈ¬œ¬Ζ÷Ϋβ…ζ≥…Νρ’τΤχΚΆ![]() Θ§»τΖ¥”Π‘Ύ≤ΜΆ§Έ¬Ε»œ¬¥οΒΫΤΫΚβ ±Θ§ΜλΚœΤχΧε÷–ΗςΉιΖ÷ΒΡΧεΜΐΖ÷ ΐ»γΆΦ2Υυ ΨΘ§
Θ§»τΖ¥”Π‘Ύ≤ΜΆ§Έ¬Ε»œ¬¥οΒΫΤΫΚβ ±Θ§ΜλΚœΤχΧε÷–ΗςΉιΖ÷ΒΡΧεΜΐΖ÷ ΐ»γΆΦ2Υυ ΨΘ§![]() ‘ΎΗΏΈ¬œ¬Ζ÷ΫβΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ ΓΘ
‘ΎΗΏΈ¬œ¬Ζ÷ΫβΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ ΓΘ
![]() ΩΤ―ßΦ“”ΟΒΣΜ·οΊ≤ΡΝœ”κΆ≠ΉιΉΑ»γΆΦ3ΒΡ»ΥΙΛΙβΚœœΒΆ≥Θ§άϊ”ΟΗΟΉΑ÷Ο≥…ΙΠΒΊ Βœ÷ΝΥ“‘
ΩΤ―ßΦ“”ΟΒΣΜ·οΊ≤ΡΝœ”κΆ≠ΉιΉΑ»γΆΦ3ΒΡ»ΥΙΛΙβΚœœΒΆ≥Θ§άϊ”ΟΗΟΉΑ÷Ο≥…ΙΠΒΊ Βœ÷ΝΥ“‘![]() ΚΆ
ΚΆ![]() Κœ≥…
Κœ≥…![]() ΓΘ
ΓΘ
![]() –¥≥ωΆ≠ΒγΦΪ±μΟφΒΡΒγΦΪΖ¥”Π ΫΈΣ______ ΓΘ
–¥≥ωΆ≠ΒγΦΪ±μΟφΒΡΒγΦΪΖ¥”Π ΫΈΣ______ ΓΘ
![]() ΈΣΧαΗΏΗΟ»ΥΙΛΙβΚœœΒΆ≥ΒΡΙΛΉς–߬ Θ§Ω…œρΉΑ÷Ο÷–Φ”»κ…ΌΝΩ______
ΈΣΧαΗΏΗΟ»ΥΙΛΙβΚœœΒΆ≥ΒΡΙΛΉς–߬ Θ§Ω…œρΉΑ÷Ο÷–Φ”»κ…ΌΝΩ______ ![]() ―ΓΧνΓΑ―ΈΥαΓ±ΜρΓΑΝρΥαΓ±
―ΓΧνΓΑ―ΈΥαΓ±ΜρΓΑΝρΥαΓ±![]() ΓΘ
ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com