
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
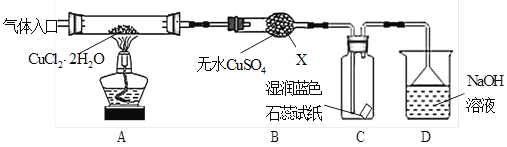
请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
【答案】(1)球形干燥管;(2)c、d、b;(3)先逐渐变为红色,后褪色;(4)Cl2+2OH-=Cl-+ClO-+H2O;(5)①加热温度不够;②没有在HCl的氛围中加热。
【解析】试题分析:(1)根据仪器X的构造特点知其名称为干燥管,答案为:干燥管。
(2)加热CuCl2·2H2O制备CuCl,为防止生成的CuCl被空气中的氧气氧化和Cu+水解,必须要先通入干燥的HCl气体赶走装置中的空气再加热,且要在HCl气流中加热制备,反应结束后先熄灭酒精灯,继续通入氮气直至装置冷却,所以操作顺序为:a-c-d-b-e,答案为:c d b。
(3)B中物质由白色变为蓝色,说明有水生成,产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色,答案为:先变红,后褪色。
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,答案为:Cl2+2OH-=Cl-+ClO-+H2O。
(5)①根据题给信息知若杂质是CuCl2,说明CuCl2没有反应完全,原因为加热时间不足或温度偏低,答案为:加热时间不足或温度偏低;②若杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO,原因是通入HCl的量不足,答案为:通入HCl的量不足。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列12种物质:① 空气;②H2O;③ Mg;④CaO;⑤ H2SO4;⑥Ca(OH)2;⑦CuSO4·5H20;⑧ 碘酒;⑨CH3CH2OH;⑩ NaHCO3;![]() 淀粉溶液;
淀粉溶液;![]() 盐酸。
盐酸。
(1)属于混合物的是_______(填序号,下同);
(2)属于氧化物的是_______;
(3)属于盐的是___________;
(4)属于碱的是__________;
(5)可出现丁达尔效应的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是常用的氨化剂之一。某研究小组利用反应原理:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH<0制备氨基甲酸铵,其装置如图所示,已知:H2NCOONH4(s)白色固体,易分解、易水解。则下列观点不正确的是( )
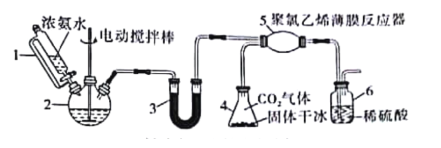
A.仪器1是恒压漏斗,该实验用于防倒吸
B.仪器2和仪器3都可以放置NaOH固体
C.为了完成实验,应在装置5和6之间,依次添加干燥装置和安全瓶
D.若反应初期观察到装置6内稀硫酸溶液中产生气泡,应控制旋塞,加大浓氨水的流速
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列流程有关判断正确的是
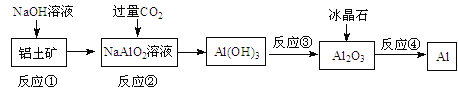
A.流程中涉及的反应均为非氧化还原反应
B.反应②产生的阴离子主要为CO32-
C.实验室中完成反应③应在蒸发皿中进行
D.反应④的条件是电解熔融
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
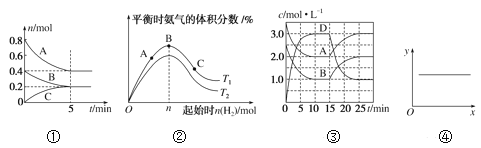
A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。图一为阳离子交换膜法电解原理示意图。请回答下列问题:
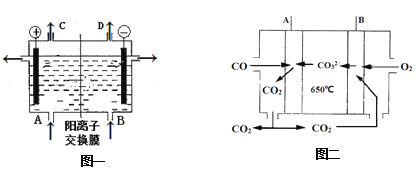
(1)反应的离子方程式是___。A、B、C、D所对应物质化学式分别为__________、____、______、_______,每通过0.1mol电子,就有0.1mol____(填离子符号)通过离子交换膜。
(2)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH- = 5Cl-+ClO3-+3H2O),下列说法正确的组合是___________。
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O ![]() NaClO3 + 3H2↑
NaClO3 + 3H2↑
C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(3)如果用熔融碳酸盐CO燃料电池供电,图二为其工作原理,A、B极的电极反应分别是____、_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com