
����Ŀ��NH3 ��һ����Ҫ�Ļ���ԭ�ϣ���ҵ���� H2��N2�ϳɡ�
��1����ҵ���ɽ�̿����Ȼ���������Ĺ����л����һ����̼��Ϊ�˾�����ȥ�����л��е� һ����̼�����ڴ������ڵ������·�����Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H=��41.0kJ/mol �÷�Ӧ�ڹ�ҵ�ϱ���Ϊ��һ����̼�任����Ӧ��
CO2��g��+H2��g����H=��41.0kJ/mol �÷�Ӧ�ڹ�ҵ�ϱ���Ϊ��һ����̼�任����Ӧ��
����һ���ݻ�Ϊ 2L �ĺ����ܱ������м��� 1molCO �� 3molH2O��g��������������Ӧ��5min ��ﵽƽ�⣬��÷ų�����Ϊ 20.5kJ�����ʱ����ڷ�Ӧ��ƽ��������(CO)=______�����¶��¸÷�Ӧƽ�ⳣ�� K=_____�����¶����ڴ������м��� 3molCO �� 1molH2O��g������������Ӧ���ﵽƽ���ų��� ��_____20.5kJ(������������=����������)��
����֪��ͬ��Ӧ��Ͷ�ϱȣ�![]() ���£�ƽ���������� CO ������������±���ʾ��
���£�ƽ���������� CO ������������±���ʾ��
�¶�(��)\Ͷ�ϱ� | 1 | 3 | 5 |
200�� | 0.70 | 0.21 | 0.02 |
�ӱ������ݷ�����֪��
��Ӧ��Ͷ�ϱ�Խ��CO ��ƽ��ת����Խ________��������������С������ ���Ʋ��淴Ӧ��Ͷ�ϱ�����H2O��ƽ��ת���ʵı仯������______������ĸ����
A������ B����С C���ȼ�С������ D����������С
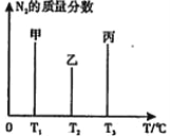
��2���� 2mol N2��3molH2�ϳɰ����������ķ�Ӧ�¶ȷֱ�Ϊ T1��T2��T3�Һ㶨���䣬�� ����������ͬ������£�ʵ���÷�Ӧ�����е�t minʱN2������������ͼ��ʾ����ʱ�ס��ҡ�������������һ���ﵽ��ѧƽ��״̬����_____�����ﵽƽ��״̬ʱ��N2ת������͵���________������������������������������գ�
��3��NH3��CO2��120�棬���������¿��Ժϳɷ�Ӧ�������أ� CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)�ں��º��ݵ��ܱ�������Ͷ�뷴Ӧ����������NH3�ĺ����仯��ϵ��ͼ��ʾ����
CO(NH2)2(s)+H2O(g)�ں��º��ݵ��ܱ�������Ͷ�뷴Ӧ����������NH3�ĺ����仯��ϵ��ͼ��ʾ����
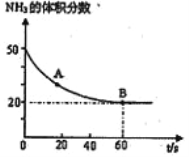
A ����淴Ӧ����V����CO2��_____B �������Ӧ���� V����CO2��(���������� ��=����������)��NH3��ƽ��ת����Ϊ____________��
��4����֪ NH2COONH4(s)![]() 2NH3(g)+CO2(g)������һ�� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����P1____________P2�� ��1_____________________��2(������������=����������)��
2NH3(g)+CO2(g)������һ�� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����P1____________P2�� ��1_____________________��2(������������=����������)��
���𰸡� 0.05mol/��Lmin) 0.2 = �� B �� �� �� 75% = =
����������1���ٸ��ݷ�Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H=��41.0kJ/mol 5min ��ﵽƽ�⣬��÷ų�����Ϊ 20.5kJ����Ӧ����CO�����ʵ���Ϊ
CO2��g��+H2��g����H=��41.0kJ/mol 5min ��ﵽƽ�⣬��÷ų�����Ϊ 20.5kJ����Ӧ����CO�����ʵ���Ϊ![]() �����ʱ����ڷ�Ӧ��ƽ������
�����ʱ����ڷ�Ӧ��ƽ������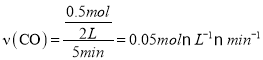 �����¶���CO��H2O��CO2��H2��ƽ��Ũ�ȷֱ�Ϊ0.25mol/L��1.25mol/L��0.25mol/L��0.25mol/L���÷�Ӧƽ�ⳣ��
�����¶���CO��H2O��CO2��H2��ƽ��Ũ�ȷֱ�Ϊ0.25mol/L��1.25mol/L��0.25mol/L��0.25mol/L���÷�Ӧƽ�ⳣ�� ![]() �����¶����ڴ������м��� 3molCO �� 1molH2O��g������������Ӧ��ǰһ��ΪCOת����50%����һ��ΪH2O��g��ת����50%���ﵽƽ���ų�����=20.5kJ���ڸ��ݱ������ݿ�֪����Ӧ��Ͷ�ϱ�Խ��CO ��ƽ��ת����Խ�� ���Ʋ��淴Ӧ��Ͷ�ϱ�����H2O��ƽ��ת���ʵı仯�����Ǽ�С����ѡB����2���÷�Ӧ�Ǵ�����Ӧ����ʼ�ģ��������ŷ�Ӧ�Ľ��У�N2��Ũ����С���京��Ҳ�ڲ��Ͻ��ͣ�����Ӧ�ﵽƽ��ʱ�ﵽ��Сֵ���˺����ŷ�Ӧ�¶ȵ����ߣ���ѧƽ�������ƶ���N2��Ũ���������京��Ҳ�ڲ������ࡣ����T3��T2ʱ�࣬˵��T3��״̬�����Ѿ��ﵽƽ��״̬�ģ�����һ���ﵽƽ��״̬��T2ʱ�Ƿ�ﵽƽ��״̬����ȷ���������߶��ﵽƽ��״̬�������¶�T1< T2<T3�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ���N2��ת���ʽ��͡������ڶ��ﵽƽ��״̬ʱ��N2ת������͵��DZ�����3����ӦCO2(g)+2NH3(g)
�����¶����ڴ������м��� 3molCO �� 1molH2O��g������������Ӧ��ǰһ��ΪCOת����50%����һ��ΪH2O��g��ת����50%���ﵽƽ���ų�����=20.5kJ���ڸ��ݱ������ݿ�֪����Ӧ��Ͷ�ϱ�Խ��CO ��ƽ��ת����Խ�� ���Ʋ��淴Ӧ��Ͷ�ϱ�����H2O��ƽ��ת���ʵı仯�����Ǽ�С����ѡB����2���÷�Ӧ�Ǵ�����Ӧ����ʼ�ģ��������ŷ�Ӧ�Ľ��У�N2��Ũ����С���京��Ҳ�ڲ��Ͻ��ͣ�����Ӧ�ﵽƽ��ʱ�ﵽ��Сֵ���˺����ŷ�Ӧ�¶ȵ����ߣ���ѧƽ�������ƶ���N2��Ũ���������京��Ҳ�ڲ������ࡣ����T3��T2ʱ�࣬˵��T3��״̬�����Ѿ��ﵽƽ��״̬�ģ�����һ���ﵽƽ��״̬��T2ʱ�Ƿ�ﵽƽ��״̬����ȷ���������߶��ﵽƽ��״̬�������¶�T1< T2<T3�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ���N2��ת���ʽ��͡������ڶ��ﵽƽ��״̬ʱ��N2ת������͵��DZ�����3����ӦCO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)�ж�����̼�Ƿ�Ӧ�A �㷴Ӧ��������������У�û�дﵽƽ�⣬��A�������̼Ũ�ȴ���B�㣬��A ���淴Ӧ����V����CO2����B �������Ӧ���� V����CO2������ʼʱNH3���������Ϊ50%����NH3��CO2��1mol/L��ƽ��ʱNH3���������Ϊ20%����ƽ��ת����Ϊx����
CO(NH2)2(s)+H2O(g)�ж�����̼�Ƿ�Ӧ�A �㷴Ӧ��������������У�û�дﵽƽ�⣬��A�������̼Ũ�ȴ���B�㣬��A ���淴Ӧ����V����CO2����B �������Ӧ���� V����CO2������ʼʱNH3���������Ϊ50%����NH3��CO2��1mol/L��ƽ��ʱNH3���������Ϊ20%����ƽ��ת����Ϊx����
CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
��ʼʱŨ��(mol/L) 1 1 0
�ı��Ũ��(mol/L) ![]() x
x ![]()
ƽ��ʱŨ��(mol/L) 1-![]() 1-x
1-x ![]()
![]() �����x=0.75mol/L��ת����Ϊ
�����x=0.75mol/L��ת����Ϊ![]() ��4����֪ NH2COONH4(s)
��4����֪ NH2COONH4(s)![]() 2NH3(g)+CO2(g)������һ���� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����С����൱������ѹǿ����NH2COONH4�ǹ��壬ѹǿ�������죬����ѹP1=P2��ѹǿ���䣬����������䣬��ӦΪ��Чƽ�⣬ ��1=��2��
2NH3(g)+CO2(g)������һ���� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����С����൱������ѹǿ����NH2COONH4�ǹ��壬ѹǿ�������죬����ѹP1=P2��ѹǿ���䣬����������䣬��ӦΪ��Чƽ�⣬ ��1=��2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������³������������һ�־ֲ����������������ýϿ졢��ǿ�����Խϵͣ���ϳ�·�����£���Ӧ����ʡ�ԣ���

��1��![]() �Ļ�ѧ������__________________���˴Ź���������______�ֲ�ͬ��ѧ�������⡣
�Ļ�ѧ������__________________���˴Ź���������______�ֲ�ͬ��ѧ�������⡣
��2����Ӧ������Ҫ�Լ�Ϊ_________________________________��
��3����Ӧ�۵ķ�Ӧ������_________________________________��
��4����Ӧ�ܵĻ�ѧ����ʽΪ_________________________________��
��5��C�ķ���ʽΪ_________________________________��
��6�� ��ͬ���칹���У�������ͬ�����ţ���Ϊ1��3��5����ȡ�����ṹ����6�֣�����4�ֽṹ����ͼ��ʾ��
��ͬ���칹���У�������ͬ�����ţ���Ϊ1��3��5����ȡ�����ṹ����6�֣�����4�ֽṹ����ͼ��ʾ��
��д����������ͬ���칹��Ľṹ��ʽ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO��NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1���뵪�������йص�ȫ��������Դ�������������_______(����ĸ���)��
a������ b��ɳ���� c.�⻯ѧ���� d����ɫ��Ⱦ
��2��NO2����ˮ������Ӧ����Ӧ�Ļ�ѧ����ʽΪ___________�����÷�Ӧ��0.6NA������ת�ƣ���μӷ�Ӧ��NO2�����ʵ���Ϊ___________��
��3��NH3Ҳ����Ҫ�ĺ��������ʵ������NH4Cl��Ca(OH)2��ȡNH3��
��д����Ӧ�Ļ�ѧ����ʽ_________________
��������ͼ��ʾװ���ռ�������������_____�ڽ��롣

��4��������벻���ý���ͭ������Ӧ����������ͭ����һ������Ũ�����У��ȣ���ַ�Ӧ����Ӧֹͣ���ټ�������25%��ϡ���ᣬ��ʱͭƬ���������ݲ�������ԭ���ǣ������ӷ���ʽ������_____________________
��5������12.8 gͭ��һ��������Ũ���ᷴӦ��ͭ����ʱ������������5.6 L(��״��)����������Ӧ�����У�����ԭ��HNO3�ܵ����ʵ�����___________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeCl3��Һ��ʴӡˢ��·����ͭ���ķ�Ӧ�ǣ�2Fe3++Cu = 2Fe2++ Cu2+�������й�˵���������( )
A.Cu�ǻ�ԭ��������ʴ
B.Fe3+��������
C.�÷�Ӧ���û���Ӧ
D.�÷�Ӧ�������ӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᴿ��������Ba(NO3)2���ʵ�KNO3��Һ����ʹ�õķ���Ϊ( )
A.�������Na2CO3��Һ�����ˣ���ȥ��������Һ�в�����������
B.�������K2SO4��Һ�����ˣ���ȥ��������Һ�в�����������
C.�������Na2SO4��Һ�����ˣ���ȥ��������Һ�в�����������
D.�������K2CO3��Һ�����ˣ���ȥ��������Һ�в�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡ�������ҹ������ս����Դ����֪ϡ��Ԫ����(Sm)��ԭ��������62��Sm��ij��ͬλ����������82������������( )
A.144B.82C.62D.20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��H3Aˮ��Һ�к�A�ĸ������ӵķֲ�����(ƽ��ʱij�����ӵ�Ũ��ռ������Ũ��֮�͵ķ���)��pH��ϵͼ������ʾ������˵����ȷ����
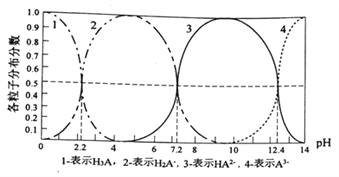
A. NaH2Aˮ��Һ�ʼ���
B. H3A��Һ�д���:c(H+)=c(OH-)+c(H2A-)+![]() c(HA2-)+
c(HA2-)+![]() c(A3-)
c(A3-)
C. ��H3A��Һ�м���һ������NaOH��Һ��pH=5ʱ��![]()
D. ��H3A��Һ�м��백ˮʹPH��5��9��������Ҫ���ӷ�Ӧ��:H2A-+OH-=HA2-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ͼ���о�������������Ӧ��ʵ��װ��ͼ��
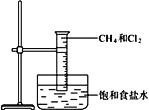
��1��CCl4�ĵ���ʽ��________________��
��2�����ȼ���_____________ͬ���칹�壨��С���û�С�����
��3�������һ�ȼ���������������Ӧ�Ļ�ѧ����ʽ��CH3Cl+Cl2![]() ________+HCl���÷�Ӧ���ڷ�Ӧ_________�����л���Ӧ���ͣ���
________+HCl���÷�Ӧ���ڷ�Ӧ_________�����л���Ӧ���ͣ���
��.��4��д�������л���Ľṹ��ʽ��
��2��2���������飺_____________
��3������1����ϩ��________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(C8H18)�����͵���Ҫ�ɷ�,����O2��Ӧ�������仯��ͼ��ʾ�������ж���ȷ����
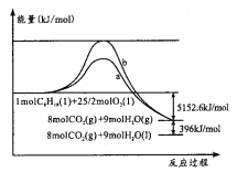
A. ����b�����������ʱ�������仯
B. ��Ӧ���������С���������������
C. ��ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ��H=-5152.6kJ/mol
D. ��Ӧa��b�Ļ�ܲ�ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com