
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 第④步电解得到,镁的方程式为MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D. 提取镁的过程涉及化合、分解、置换反应
【答案】D
【解析】
海水中提取镁的步骤:碳酸钙高温分解为氧化钙,氧化钙溶于水生成氢氧化钙,氢氧化钙加入到海水中,镁离子与氢氧化钙反应生成氢氧化镁沉淀,富集镁元素;然后加入盐酸溶解氢氧化镁变为氯化镁溶液,氯化镁溶液经蒸发浓缩、冷却结晶、过滤等得到氯化镁晶体,在不断通入氯化氢气流的情况下,加热蒸干得到无水氯化镁,最后电解熔融的氯化镁得到金属镁,据以上分析解答。
根据题干信息可知有关的反应为CaCO3![]() CaO+CO2↑,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=2H2O+MgCl2,MgCl2(熔融)
CaO+CO2↑,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=2H2O+MgCl2,MgCl2(熔融)![]() Mg+Cl2↑,则:
Mg+Cl2↑,则:
A.根据有关原理可知此法的优点之一是原料贝壳、海水来源丰富,A正确;
B.由方程式可看出前三步目的就是为了从海水中获得制取Mg的原料MgCl2,B正确;
C.由上可知电解MgCl2得到镁的方程式MgCl2(熔融)![]() Mg+Cl2↑,C正确;
Mg+Cl2↑,C正确;
D.根据有关原理可判断提取镁的过程涉及化合、分解、复分解反应,但没有发生置换反应,D错误;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):

已知:①RCH=CH2+CH2==CHR′![]() CH2=CH2+RCH=CHR′;
CH2=CH2+RCH=CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2C=CH2的同分异构体中存在顺反异构的有机物的名称为________。
(2)A的核磁共振氢谱除苯环上的H外,还显示________组峰,峰面积比为________。
(3)D分子中含有的含氧官能团名称是________,E的结构简式为__________________。
(4) 发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
(5)G的同分异构体中,同时满足下列条件的有________种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“-COO-”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下黑作坊用病死猪肉腌制的腊肉往往含有大量的细菌,可利用“荧光素——荧光素酶生物发光法”对市场中腊肉含细菌多少进行检测:①将腊肉研磨后离心处理,取一定量上清液放入分光光度计(测定发光强度的仪器)反应室内,加入适量的荧光素和荧光素酶,在适宜条件下进行反应;②记录发光强度并计算ATP含量;③测算出细菌数量。分析并回答下列问题:
(1)荧光素接受____提供的能量后就被激活,在荧光素酶的作用下形成氧化荧光素并且发出荧光。根据发光强度可以计算出生物组织中ATP的含量,原因是发光强度与ATP含量成____________(正比/反比);根据ATP含量进而测算出细菌数量的依据是:每个细菌细胞中ATP含量__________。
(2)“荧光素——荧光素酶生物发光法”中涉及的能量转换是_________;生物细胞中ATP的水解一般与________(吸能反应或放能反应)相联系。
(3)研究人员用不同条件处理荧光素酶后,测定酶浓度与发光强度如图所示。
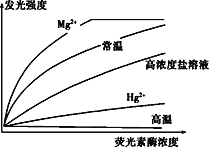
其中高浓度盐溶液经稀释后酶活性可以恢复,高温和Hg2+处理后酶活性不可恢复。若要节省荧光素酶的用量,可以使用____处理;Hg2+处理后酶活性降低可能是因为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ ,然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①到达滴定终点时,俯视碱式滴定管读数,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②达到滴定终点时,发现碱式滴定管的尖端有气泡,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察___________
④滴定达到终点判断:__________________________________________
(2)滴定结果如下表所示:
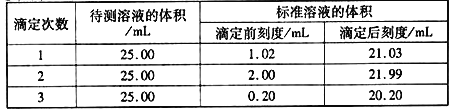
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为利用海水制备部分物质的过程。下列有关说法正确的是
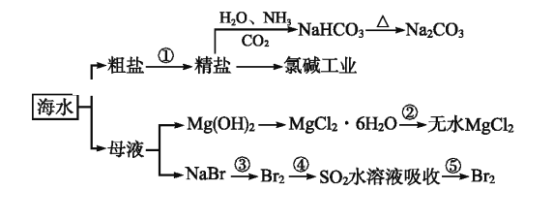
A. 制取NaHCO3的反应是利用其溶解度小于NaCl的溶解度
B. 用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 加热MgCl2溶液制取无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1000mol·L-1的H3PO4溶液用0.1000mol·L-1的NaOH溶液进行滴定,其滴定曲线如下图所示[已知:滴定分数a=n(滴定液中溶质)/n(被滴定溶质)]。下列说法正确的是

A. n=1时,c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)
B. n=1.5时,2c(Na+)>3c(H3PO4)+3c(HPO42-)
C. n=2时,c(Na+)>c(HPO42-)>c(PO43-)>c(H2PO4-)
D. n=3时,c(OH-)=c(H+)+c(HPO42-)+c(H2PO4-)+c(H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.己知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-
H++A2-
(1)某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是__________。
A.c(H+)·c(OH-)=l.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol·L-1
(2)己知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(1)该废水中加入绿矾和H+,发生反应的离子方程式为________________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com