
����Ŀ��������ĿҪ��ش��������⡣
��1�������£�Ũ�Ⱦ�Ϊ0.lmol��L-1������������Һ��pH���±���
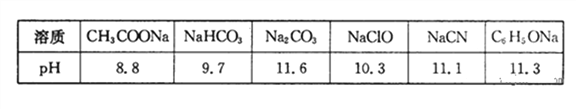
����������Һ�е������ӣ����H+������ǿ����______
�ڸ��ݱ������ݣ�Ũ�Ⱦ�Ϊ0.0lmol��L-1�������������ʵ���Һ�У�������ǿ����______�����ţ���������Һ�ֱ�ϡ��100����pH�仯��С����______�����ţ�
![]()
�۾��ϱ����ݣ������ж����з�Ӧ���ܳ�������______�����ţ�
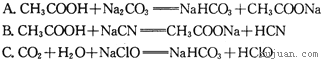
![]()
��2����֪������![]() ����֪������ijCuSO4��Һ��c��Cu2+��=0.02mol��L-1�����Ҫ����Cu��OH��2��������Ӧ������ҺpH����______��
����֪������ijCuSO4��Һ��c��Cu2+��=0.02mol��L-1�����Ҫ����Cu��OH��2��������Ӧ������ҺpH����______��
��3����֪���淴Ӧ![]() ��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
 ��д���÷�Ӧƽ�ⳣ���ı���ʽ��______
��д���÷�Ӧƽ�ⳣ���ı���ʽ��______
�����÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬���ı����������������¶ȣ����������ܶ�______��ѡ�������С�����䡱����
���𰸡� CO32- D C D 5 K= ![]() ��С
��С
����������1���ٸ��ݱ������ݿ�֪̼������Һ�ļ�����ǿ��˵��̼�����ˮ��̶����������ӵ�������ǿ�������H+������ǿ����CO32-������Խ������Ӧ���Խ����ˮ�⣬��˸��ݱ������ݿ�֪�������ǿ����С˳��Ӧ���ǣ�CH3COOH��H2CO3��HClO��HCN��C6H5OH����������ǿ���Ǵ��ᣬ��ѡD��ϡ��ͬ�����������£�����ԽС������pH�仯ԽС����ѡC���۸��ݽ�ǿ���Ʊ��������ԭ����֪ѡ��A��B��C�еķ�Ӧ���ܷ��������ӵ���������̼�ᣬ��ǿ��̼�����ƣ���˱�������̼�ᷴӦ���ɱ��Ӻ�̼�����ƣ���ѡD����2��Ksp[Cu(OH)2]��c(Cu2+)��c2(OH��)����c��Cu2+����0.02mol��L-1ʱ��c(OH��)��1��10-9 mol��L-1����c(H��)��1��10-5mol��L-1������pHҪ����5����3���ٸ�ƽ����FeO��FeΪ���壬Ũ��Ϊһ��ֵ�����ݷ���ʽ��֪�÷�Ӧƽ�ⳣ���ı���ʽΪ![]() �������¶Ⱥ�ƽ�ⳣ��K��ϵ����֪��Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淽���ƶ������������ܶȼ�С��
�������¶Ⱥ�ƽ�ⳣ��K��ϵ����֪��Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淽���ƶ������������ܶȼ�С��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У�������뻹ԭ�����ܷ������ǣ�������
A.SO2��SB.S��SO2
C.SO32����SO2D.HCO3����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ƶ���������ԀΪ�������һ���������������š������øֻ������������������ܹ㷺Ӧ�����ճ������������������ʱ���溬�м�����������ʹ�øֻ������ڼ��������µ�ʹ���ܵ�����.
��1����̬��ԭ�Ӽ۲���ӵĹ������ʽ(�����Ų�ͼ)Ϊ____________����̬��ԭ���к������ռ������ܲ�ķ���Ϊ_____________.
��2��Ni(CO)4�������Ʊ������������Ҵ���CCl4�������л��ܼ���Ϊ___________���壬Ni(CO)4�ռ乹���������ͬ������ԭ�ӵ��ӻ��������Ϊ___________��д�������廥Ϊ�ȵ������������__________________________________________________________(��дһ��).
��3������ͬ�����Ԫ�������ֳ����Ķ�Ԫ�����ᣬ��Ƚ���������ǿ�� > (�ѧʽ)______��������_______________________________________________________________.
��4��H2S�ļ���__________(����ڡ���С�ڡ������ڡ�)H2O�ļ��ǣ���ӵ縺�ԵĽǶ�˵������___________________________________________________.
��5��NiO��NaCl�ľ����ṹ���ƣ���ͼ��ʾ�������Ӳ�ȡ���������ѻ��������������λ�������ӹ��ɵĿ�϶�У���֪Ni2+�뾶Ϊ69nm��O2-�뾶Ϊ140nm������٤������ΪNA��NiO������ܶ�Ϊ_________g/cm3(ֻ�г�����ʽ).

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С�齫����������Ʊ���������ʵ�������һ�廯���,ʵ��װ����ͼ��ʾ������˵������ȷ����
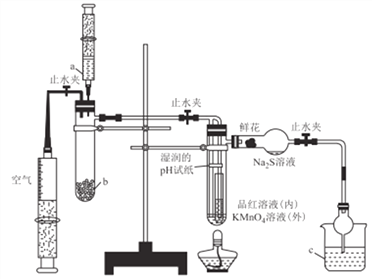
A. a��b��c������ʢװ70%����.Na2SO3���塢NaOH��Һ
B. ʵ��ʱ��ʪ���pH��ֽ���ʻ���Ʒ����Һ��KMnO4��Һ����ɫ��Na2S��Һ���ֵ���ɫ����
C. ����ƿ�֤��SO2ˮ��Һ������,SO2�������ԡ���ԭ�ԡ�Ư����
D. ��ȼ�ƾ��Ƽ���,��֤��SO2ʹƷ����Һ��ɫ���п�����,ʹKMnO4��Һ��ɫ�����п�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þͭ�Ͻ���뵽ϡ�����У�����ǡ����ȫ��Ӧ�����跴Ӧ�����л�ԭ����ȫ��NO����������Һ�м������ʵ���Ũ��Ϊ3 mol��L��1 NaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1 g���������й���������ȷ���ǣ� ��
A. ����Ͻ������������Ϊ6.4 g
B. �μӷ�Ӧ����������ʵ���Ϊ0.1 mol
C. ������ȫʱ����NaOH��Һ�����Ϊ150 mL
D. �ܽ�Ͻ�ʱ�ռ���NO���������ڱ�״����Ϊ2.24 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����R��NO2![]() R��NH2���ڱ����ϵ�ȡ�������µ����ȡ�������뱽����λ����������Ӱ�졣��ͼ��ʾ�Ա�Ϊԭ���Ʊ�һϵ���л����ת�����̣�
R��NH2���ڱ����ϵ�ȡ�������µ����ȡ�������뱽����λ����������Ӱ�졣��ͼ��ʾ�Ա�Ϊԭ���Ʊ�һϵ���л����ת�����̣�
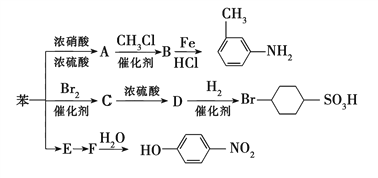
��1��A��һ���ܶȱ�ˮ___(���С��)����ɫҺ�壬��ת��ΪA�Ļ�ѧ����ʽ��________________________________________________��
��2���ڡ���![]() C
C![]() D
D![]()
![]() ����ת�������У�����ȡ����Ӧ����___(����ţ���ͬ)�����ڼӳɷ�Ӧ����_______��
����ת�������У�����ȡ����Ӧ����___(����ţ���ͬ)�����ڼӳɷ�Ӧ����_______��
��3��ͼ�С�����E��F����ת������ʡ���˷�Ӧ��������д��E�Ľṹ��ʽ��________��
��4���л���B�����ϵĶ��ȴ�����___�ֽṹ��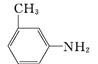 ������ԭ��___(��ڡ����ڡ�)ͬһƽ���ϡ�
������ԭ��___(��ڡ����ڡ�)ͬһƽ���ϡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ�����ǻ��������������г��õ�һ�ַ������ش��������⣺
��1���������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹�������ͼ��ʾ��
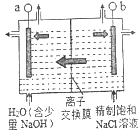
��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������ClO2�ĵ缫Ӧ���ӵ�Դ��______���������������������Ӧ�ĵ缫��ӦʽΪ_____________________��
��a����pH________�����������С�����䡱����
��ͼ��Ӧʹ��_______������������������ӽ���Ĥ��
��2��ȼ�ϵ������з���Ч�ʸߡ�������Ⱦ�ٵ��ŵ���������ǹ�ע��ijȼ�ϵ��������NaOH��ҺΪ����ʣ��Լ���Ϊȼ�ϣ�����Ϊ���������Ծ��д����ú͵������ܵ�ij��������Ϊ�缫�����صĸ�����ӦʽΪ_____________��
��3���������������þú�����׳��ֺڰߣ�Ag2S�������õ绯ѧԭ���ɴ����ڰߡ����������������������ʳ��ˮ�в������Ӵ���Ag2Sת��ΪAg���������ĵ缫��ӦʽΪ____�����������У������а�ɫ�����ͳ�������ζ��������������Ƿֱ���______��______���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±��Ԫ�صĵ��ʺͻ���������������������Ҫ����;��
��1����ԭ�ӵļ۵����Ų�ͼΪ__________��
��2����һ��Ũ�ȵ� HF ��Һ�У����������Ե���ʽ(HF)2 ���ڵġ�ʹ��������ӵϵ���������____________��
��3�������±����ݣ������۵��Ӳ�ȱ仯��ԭ��________________��

��4��HIO3 ������_____���>����<����HIO4��ԭ����_________________��
��5����������������Ҫ�أ��������������ʾ�����ڲ����������λ�á���ͼ�� CaF2 �ľ���������ԭ��������� A Ϊ(0��0��0)��B Ϊ(1/2�� 1/2��0)��C Ϊ(1��1��1)���� D �����������Ϊ____��

�ھ����������������߳��������������Ĵ�С����״����֪ CaF2 ������ܶ�Ϊ c gcm3������ Ca2+����������� F֮��ľ���Ϊ______nm���� NA Ϊ�����ӵ�������ֵ���ú� c��NA ��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com