
【题目】(1)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,则乙醇燃烧的热化学方程式__。
(2)已知下列热化学方程式:
①C(s,石墨)+O2(g)═CO2(g) △H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l) △H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H=-2599kJmol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式_____。
(3)已知几种共价键的键能数据如下表:
共价键 | N≡N | H—H | N—H |
键能(kJ/mol) | 946 | 436 | 390.8 |
写出合成氨反应的热化学方程式:____。
【答案】C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1366.89kJ·mol-1 2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJmol-1 N2(g)+3H2(g)![]() 2NH3(g) ΔH=-90.8kJ·mol-1
2NH3(g) ΔH=-90.8kJ·mol-1
【解析】
(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,乙醇完全燃烧生成二氧化碳和液态水,依据2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,计算1mol乙醇燃烧完全燃烧生成液态水放出的热量,据此书写乙醇燃烧热的热化学方程式;
(2)利用盖斯定律计算反应热,并书写热化学方程式;
(3)根据反应热=反应物的总键能-生成物的总键能,利用化学计量数关系分析焓变,由此分析解答。
(1)1 mol乙醇燃烧时放出的热量为59.43 kJ×![]() =1366.89 kJ,则乙醇燃烧热的化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1366.89 kJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1366.89kJ·mol-1;
=1366.89 kJ,则乙醇燃烧热的化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1366.89 kJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1366.89kJ·mol-1;
(2)①C(s,石墨)+O2(g)═CO2(g) △H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l) △H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H=-2599kJmol-1
利用盖斯定律将①-![]()
![]() 可得:
可得:
2C(s,石墨)+H2(g)=C2H2(g) △H=(-393.5kJ/mol)-2×(-571.6kJ/mol)-(-2599 kJ/mol)= +226.7kJmol-1,
所以热化学反应方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJmol-1;
(3)N≡N的键能是946 kJ·mol-1,HH的键能为436 kJ·mol-1,NH的键能为390.8 kJ·mol-1,则N2(g)+3H2(g)![]() 2NH3(g) ΔH=946 kJ·mol-1+3×436 kJ·mol-16×390.8 kJ·mol-1=90.8 kJ·mol-1,该热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=946 kJ·mol-1+3×436 kJ·mol-16×390.8 kJ·mol-1=90.8 kJ·mol-1,该热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-90.8kJ·mol-1。
2NH3(g) ΔH=-90.8kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:

已知:①稀土离子易和SO![]() 形成复盐沉淀:
形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O==== Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有________________________________________
(2)CeFCO3中Ce元素的化合价为___________,滤渣A的主要成分是_____________
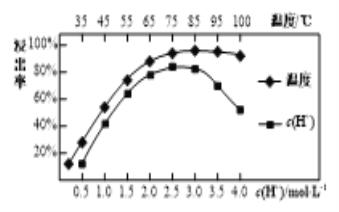
(3)焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为___________,硫酸浓度过大时,浸出率减小的原因是__________。
(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为_________。
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为_________。
(6)步骤④的离子方程式为________________________。
(7)取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+==== Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
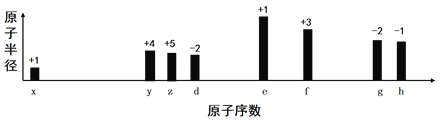
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
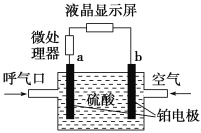
A.呼出气体中酒精含量越高,微处理器中通过的电流越小
B.电解质溶液中的H+移向a电极
C.b为正极,电极反应式为O2+2H2O+4e-=4OH-
D.a极上的电极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池(如图)工作时,下列叙述正确的是( )

A. 正极反应为Zn-2e-==Zn2+
B. 电池反应为Zn+Cu2+==Zn2++Cu
C. 盐桥中的K+移向ZnSO4溶液
D. 在外电路中,电流从负极流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝 | 氧化性:Fe2+>I2 |
B | 向3 mL KI溶液中滴加几滴氯水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Cl2的氧化性比I2的强 |
C | 向Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)<Ksp(Ag2CO3) |
D | 苯和液溴在FeBr3的催化下发生反应,将得到的气体直接通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生取代反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
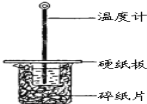
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;

(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com