
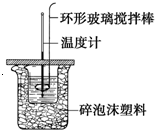
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验序号 | 起始温度t1/℃ | 终止温度t1/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
| 3.15℃+3.1℃+3.05℃ |
| 3 |
| 1mol |
| 0.025mol |


科目:高中化学 来源: 题型:
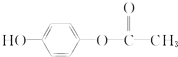 分别与足量的NaOH溶液反应,耗碱量由多到少的顺序正确的是( )
分别与足量的NaOH溶液反应,耗碱量由多到少的顺序正确的是( )| A、②⑤④③① |
| B、④②③⑤① |
| C、④②⑤③① |
| D、④⑤②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质一定含金属阳离子,弱电解质一定不含金属元素 |
| B、强电解质溶液的导电性不一定比弱电解质的导电性强 |
| C、SO3溶于水后导电性很强,所以SO3是强电解质 |
| D、强电解质是易溶化合物,弱电解质是难溶化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 |
| B、实验室里需要480mL2.0moI?L-1氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作 |
| C、25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变 |
| D、K2CO3在酒精灯上灼烧时能直接观察到紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
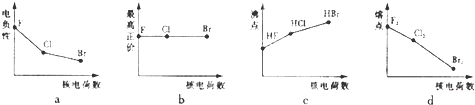
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0℃H2+F2═2HF |
| B、40℃H2+Cl2═2HCl |
| C、200℃H2+Br2(g)═2HBr |
| D、300℃H2+I2(g)═2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
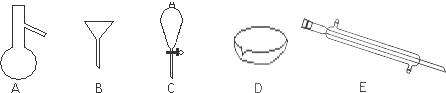
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在t℃时,Na2SO4溶液PH=7 |
| B、t℃的碳酸钠溶液升温后,溶液的水的离子积可能变为1×10-14 |
| C、t℃下,将pH=11的苛性钠溶液9L与pH=1的稀硫酸11L混合(设混合后溶液的体积为原两溶液体积之和),则所得混合溶液的pH=2. |
| D、t℃时,PH=10的CH3COONa溶液10mL加水至1000mL后,水电离出的c(OH-)=10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢离子在铜片表面被氧化 |
| B、电子通过导线由铜片流向锌片 |
| C、锌片溶解为正极 |
| D、铜片上有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com