
【题目】高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是( )
A. 7、2 B. 5、4 C. 6、3 D. 3、6
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,Y元素原子次外层电子数等于其最外层电子数的2倍。下列判断错误的是
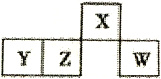
A. r(w)>r(z)>r(y)>r(x) B. 最简单气态氢化物的沸点:X>W
C. Y元素的最高价氧化物能与强碱反应 D. W的最髙价氧化物对应的水化物属于一元强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为__________;
(4)由物质M制取铝的化学方程式为____________________;
(5)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠俗称小苏打,其水溶液显____________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为___________________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者____________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的方法是____________(填“加热”或“溶解过滤”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,单质的氧化性最强的是 ( )
A. 原子最外层电子数为次外层电子数的2倍 B. 第16号元素
C. 原子核外L层电子数为K层电子数的三倍 D. 第三周期IIIA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为( )
A. 0.01 mol B. 0.02 mol C. 0.015 mol D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X 能发生如图转化(四种物质均含元素R ) ,回答下列问题:
![]()
Ⅰ.已知X是一种能使湿润的红色石蕊试纸变蓝的气体,与A化合生成一种正盐,则:
(1)X的电子式为______,写出X与Z在催化剂作用下生成两种无毒物质的化学方程式_____。
(2)在含Cu2+离子溶液中,RO2-离子可转化为RO,写出Cu+和RO2-离子在酸性水溶液中反应的离子方程式___________。
Ⅱ.若X的产量是衡量一个国家石油化工水平的标志,且Y与A在浓硫酸作用下生成一种具有香味的物质B, 则:
(1)X的分子式为________,①的反应类型是_______,工业上以X为为原料可以合成一种生活中最常见的有机高分子材料,其反应的化学方程式为__________。
(2)实验室利用Y与A制备B,写出化学反应方程式:________,实验中配制一定比例的Y、A和浓硫酸的混合液的方法(加入试剂的顺序)是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
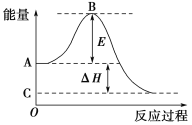
(1)图中A点表示:________________________________________;
C点表示:________________。E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com