
下列对一些事实的理论解释正确的是( )
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层有8个电子而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| D | 纯碱溶液能使湿润的紫色石蕊试纸变蓝色 | 纯碱能电离出OH-而使石蕊试纸变蓝色 |
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | FeCl3 溶液与铁反应:Fe+Fe3+═2Fe2+ |
|
| B. | 向Ca(HCO3)2溶液中加入足量NaOH溶液:Ca2++HCO3﹣+OH﹣=CaCO3↓+H2O |
|
| C. | 铝粉溶于NaOH溶液中:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ |
|
| D. | 金属钠跟水反应Na+2H2O═Na++OH﹣+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-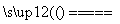 3H2↑+FeO
3H2↑+FeO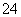 。下列说法正确的是
。下列说法正确的是
A.铁为阳极,H2SO4为电解液 B.铁为阴极,浓NaOH为电解液
C.阳极发生的电极反应为Fe+8OH--6e-===4H2O+FeO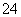
D.铁失去3 mol电子可以在阴极得到33.6 L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 溴乙烷与氢氧化钠溶液共热后加入硝酸银溶液 | 无浅黄色沉淀出现 | 溴乙烷未水解 |
| B | 向某溶液中先滴加氯水,再滴加少量KSCN溶液。 | 溶液变成血红色 | 溶液中含有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫红色 | 碘在CCl4中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高富氧底吹熔池炼铜新工艺反应炉如图
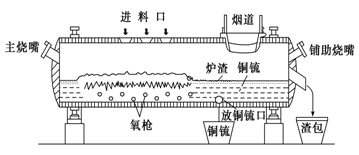
(1)该新工艺的优点之一是混合矿料不需要干燥、磨细。烟气进入余热锅炉后,经静电除尘后进入酸厂回收利用,这样做体现化学的________思想。
(2)该新工艺的优点之二是首次投料需要添加少量的燃料,当反应充分启动后就不需要再投放燃料,说明反应炉中的反应总体来说是________反应。
(3)此法冶炼的矿石主要是黄铜矿(主要成分是CuFeS2),经过上面设备煅烧后最终化合态的铜生成铜和SO2,在冶炼铜矿过程中存在重要反应:2CuFeS2+O2=Cu2S+2FeS+SO2、2Cu2S+3O2=2Cu2O+2SO2、________________________________。
(4)从放铜锍口放出的铜锍中还含有铁和硫必须除去,铜锍吹炼过程是火法冶炼生产粗铜的最后一道工序,吹炼过程分为两个阶段。第一阶段的任务是使铁氧化造渣,主要化学反应为:①2FeS+3O2+SiO2=2FeO·SiO2+2SO2 ,第二阶段是使上一个阶段中没有反应彻底的Cu2S氧化成粗铜,主要化学反应为:②Cu2S+O2=2Cu+SO2,下列关于反应①、②的分析正确的是________(填序号)
A.反应②氧化剂只有O2
B.硫元素在①和②均被氧化
C.①和②在反应过程中都有共价键破坏和共价键形成
(5)图中渣包中的炉渣含有Fe2O3、FeO 、SiO2等,选用提供的试剂设计实验验证炉渣中含有FeO。提供的试剂:KMnO4溶液、KSCN溶液、NaOH溶液、稀硫酸、稀盐酸,所选试剂为_______________。实验现象是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
若20 g密度为ρ g·cm-3的硝酸钙溶液里含1 g Ca2+,则NO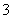 的物质的量浓度是( )
的物质的量浓度是( )
A.ρ/400 mol·L-1 B.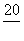 mol·L-1
mol·L-1
C.2.5ρ mol·L-1 D.1.25ρ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量 98 KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2 + I- → H2O + IO- (慢); H2O2 + IO-→ H2O + O2 + I- (快)
下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C. 反应活化能等于98 KJ•mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com