
科目:高中化学 来源: 题型:
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
|
| A. | Na+、Ba2+、Cl﹣、SO | B. | Ca2+、HCO |
|
| C. | MnO4﹣、K+、I﹣、H+ | D. | H+、Cl﹣、Na+、CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
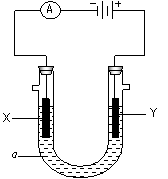 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
电解池中X极上的电极反应式为
。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要在某导电塑料表面镀一层金属铜,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电解液a选用 溶液,。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对一些事实的理论解释正确的是( )
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层有8个电子而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| D | 纯碱溶液能使湿润的紫色石蕊试纸变蓝色 | 纯碱能电离出OH-而使石蕊试纸变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由Na2O2、Na2CO3、NaHCO3、Na2O、NaCl中的某几种组成的混合物,向其中加入足量的盐酸,有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出且固体质量增加。下列判断正确的是( )
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3、Na2O
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧化铁胶体和氯化铁溶液共同具备的性质是
A.都是较稳定的红褐色液体 B. 加入盐酸后,先产生沉淀,随后沉淀溶解
C. 都有丁达尔现象 D.分散质微粒都可通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的分子量为
A.28 B.60 C.32 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 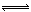 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为
mol•L-1•s-1;反应的平衡常数K1= mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T 100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2= mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向 (填“正”或“逆”)反应方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com