
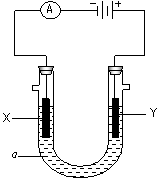
 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
电解池中X极上的电极反应式为
。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要在某导电塑料表面镀一层金属铜,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电解液a选用 溶液,。
(说明:杂质发生的电极反应不必写出)
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
在一次化学研究性学习实验中,某研究小组学生,研究分析某两瓶无标签的试剂,只知道一瓶是固体,另一瓶是液体,取少量两种试剂在试管中混合,立即产生一种无色无味的气体.现请你对此气体开展一系列探究,并完成下列实验报告.
(1)①此气体是什么物质(只写出其中可能的一种)?验证它的实验方案如下:
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是 氧气 | 将带火星的木条伸入集气瓶中 | __ 木条复燃,则证明是氧气 |
产生此气体的化学方程式可能是 2H2O2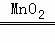 2H2O+O2↑
2H2O+O2↑
②想制取该气体(用本题中两瓶无标签的试剂),采用的发生装置可选用下图A、B、C中的 B (对应填序号).
收集该气体可选用D中的 b 装置.
③若图E是收集该气体的装置,气体由 a 端(填“a”或“b”)导入.
(2)猜想此无色气体还有无可能是另一种气体,如果有,请写出产生它的化学方程式 CaCO3+2HCl=CaCl2+H2O+CO2↑ (只须写一种).

查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-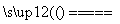 3H2↑+FeO
3H2↑+FeO 。下列说法正确的是
。下列说法正确的是
A.铁为阳极,H2SO4为电解液 B.铁为阴极,浓NaOH为电解液
C.阳极发生的电极反应为Fe+8OH--6e-===4H2O+FeO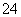
D.铁失去3 mol电子可以在阴极得到33.6 L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
以铁(足够)为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后溶液中只有一种沉淀为2 mol Fe(OH)3,则消耗水的物质的量共为
A.2 mol B.3 mol C.4 mol D.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 溴乙烷与氢氧化钠溶液共热后加入硝酸银溶液 | 无浅黄色沉淀出现 | 溴乙烷未水解 |
| B | 向某溶液中先滴加氯水,再滴加少量KSCN溶液。 | 溶液变成血红色 | 溶液中含有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫红色 | 碘在CCl4中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高富氧底吹熔池炼铜新工艺反应炉如图
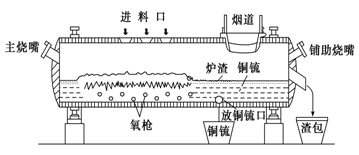
(1)该新工艺的优点之一是混合矿料不需要干燥、磨细。烟气进入余热锅炉后,经静电除尘后进入酸厂回收利用,这样做体现化学的________思想。
(2)该新工艺的优点之二是首次投料需要添加少量的燃料,当反应充分启动后就不需要再投放燃料,说明反应炉中的反应总体来说是________反应。
(3)此法冶炼的矿石主要是黄铜矿(主要成分是CuFeS2),经过上面设备煅烧后最终化合态的铜生成铜和SO2,在冶炼铜矿过程中存在重要反应:2CuFeS2+O2=Cu2S+2FeS+SO2、2Cu2S+3O2=2Cu2O+2SO2、________________________________。
(4)从放铜锍口放出的铜锍中还含有铁和硫必须除去,铜锍吹炼过程是火法冶炼生产粗铜的最后一道工序,吹炼过程分为两个阶段。第一阶段的任务是使铁氧化造渣,主要化学反应为:①2FeS+3O2+SiO2=2FeO·SiO2+2SO2 ,第二阶段是使上一个阶段中没有反应彻底的Cu2S氧化成粗铜,主要化学反应为:②Cu2S+O2=2Cu+SO2,下列关于反应①、②的分析正确的是________(填序号)
A.反应②氧化剂只有O2
B.硫元素在①和②均被氧化
C.①和②在反应过程中都有共价键破坏和共价键形成
(5)图中渣包中的炉渣含有Fe2O3、FeO 、SiO2等,选用提供的试剂设计实验验证炉渣中含有FeO。提供的试剂:KMnO4溶液、KSCN溶液、NaOH溶液、稀硫酸、稀盐酸,所选试剂为_______________。实验现象是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s),ΔH<0,下列叙述正确的是( )
2Z(g)+W(s),ΔH<0,下列叙述正确的是( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com