
【题目】某澄清透明溶液中,可能大量存在下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现进行如下实验:
,现进行如下实验:
![]() 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
![]() 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
![]() 在第2份溶液中加入新制的氯水和
在第2份溶液中加入新制的氯水和![]() ,振荡后静置,下层溶液显橙红色。
,振荡后静置,下层溶液显橙红色。
则下列推断正确的是![]()
A.溶液中一定有![]() 、
、![]() 、
、![]() 、
、![]()
B.溶液中一定没有![]() 、
、![]() 、
、![]() 、
、![]()
C.不能确定溶液中是否有![]() 、
、![]() 、
、![]()
D.往第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有![]()
【答案】A
【解析】
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出,可知无色气体为二氧化碳,一定含CO32-,溶液先浑浊后又变澄清可知一定含AlO2-,由离子共存可知,一定不含H+、Mg2+、Cu2+;
②在一份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清,加热,将湿润的红色石蕊试纸置于试管口,未见明显现象,则不含NH4+;
③在另一份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色,则一定含Br-,结合电荷守恒及离子共存解答。
![]() 由上述分析可知溶液中一定存在
由上述分析可知溶液中一定存在![]() 、
、![]() 、
、![]() 、
、![]() ,故A正确;
,故A正确;
B.不能确定是否含![]() ,故B错误;
,故B错误;
C.溶液中一定含![]() ,故C错误;
,故C错误;
D.因加盐酸引入氯离子,且原溶液中可能含![]() ,第3份溶液中滴加硝酸酸化的硝酸银溶液不能确认原溶液中是否有
,第3份溶液中滴加硝酸酸化的硝酸银溶液不能确认原溶液中是否有![]() ,故D错误;
,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】![]() 与
与![]()
![]() 的盐酸反应(放热反应)生成
的盐酸反应(放热反应)生成![]() 的量与反应时间的关系如图所示,下列结论不正确的是( )
的量与反应时间的关系如图所示,下列结论不正确的是( )
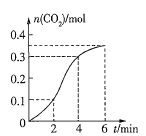
A.反应开始2min内平均反应速率最大
B.反应速率先增大后减小
C.2~4min内温度对反应速率的影响较大
D.反应在2~4min内生成![]() 的平均反应速率为
的平均反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:![]() 某无色溶液中只可能含有
某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分离子,进行下列实验:通过实验得出的结论正确的是
中的部分离子,进行下列实验:通过实验得出的结论正确的是![]()
实验编号 | 操作 | 现象 |
| 取10mL溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入过量的NaOH溶液并加热 | 产生448L气体 |
A.实验![]() 中若通入过量的
中若通入过量的![]() ,则先后氧化了
,则先后氧化了![]() 、
、![]()
B.上述3个实验不能确定是否一定含有![]() ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有
,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有![]()
C.判断溶液中是否含有钾离子,不需要通过焰色反应来检验
D.实验![]() 能够确定溶液中不含有
能够确定溶液中不含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含有![]() 的澄清溶液中,可能还含有
的澄清溶液中,可能还含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子中的几种。将该溶液进行如下实验:
六种离子中的几种。将该溶液进行如下实验:![]() 滴加适量新制氯水,有气泡生成,溶液变黄色;
滴加适量新制氯水,有气泡生成,溶液变黄色;![]() 向“
向“![]() ”中所得溶液中加入
”中所得溶液中加入![]() 溶液,无沉淀生成;
溶液,无沉淀生成;![]() 向“
向“![]() ”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液中
”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液中![]()
A.一定存在![]() 、
、![]() 、
、![]() B.无法确定
B.无法确定![]() 的存在
的存在
C.一定不存在![]() 、
、![]() 、
、![]() D.一定存在
D.一定存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
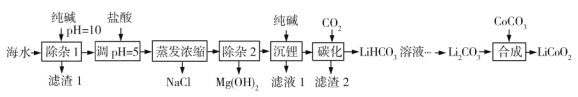
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒_______。
=______;(NH4)2SO3溶液中的质子守恒_______。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因为________________(用离子反应方程式)。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为________。
(3)SOCl2是一种液态化合物,沸点为77℃化合物,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾形成,并有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色,轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。
①根据上述实验,写出 SOCl2和水反应的化学方程式________________。
②SOCl2与AlCl3·6H2O 混合共热,可得到无水AlCl3,其原因是__________。
(4)当意外失火时,将泡沫灭火器倒过来即可使药液混合,喷出泡沫状物品,阻止火势蔓延,其相关的离子反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示正确的是( )
A.离子结构示意图:![]() 可以表示16O2-,也可以表示18O2-
可以表示16O2-,也可以表示18O2-
B.比例模型![]() 表示CH4分子或CCl4分子
表示CH4分子或CCl4分子
C.乙烯的结构简式:CH2CH2
D.硅的分子式:Si
查看答案和解析>>
科目:高中化学 来源: 题型:
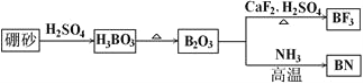
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、________________________;
(2)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4, 的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为__________,层间作用力为________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com