
【题目】已知还原性:![]() 某无色溶液中只可能含有
某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分离子,进行下列实验:通过实验得出的结论正确的是
中的部分离子,进行下列实验:通过实验得出的结论正确的是![]()
实验编号 | 操作 | 现象 |
| 取10mL溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入过量的NaOH溶液并加热 | 产生448L气体 |
A.实验![]() 中若通入过量的
中若通入过量的![]() ,则先后氧化了
,则先后氧化了![]() 、
、![]()
B.上述3个实验不能确定是否一定含有![]() ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有
,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有![]()
C.判断溶液中是否含有钾离子,不需要通过焰色反应来检验
D.实验![]() 能够确定溶液中不含有
能够确定溶液中不含有![]()
【答案】C
【解析】
无色溶液,则一定不含Fe2+;
①根据取10mL溶液,先加入稍过量的氯水,因为氯水具有酸性,生成无色气体即二氧化碳,则说明含有CO32-,无Ba2+;后加入苯并充分振荡、静置,上层为紫色,则发生萃取,说明含I-;
②向①的水溶液中加入足量BaCl2和HCl溶液,可得到白色沉淀4.66g即硫酸钡,所以①的水溶液中含有n(SO42-)=4.66/233=0.02mol,所以原溶液可能含SO32-或者SO42-或者SO32-和SO42-一共0.02mol;
③取10mL原溶液,加入过量的NaOH溶液并加热,产生448mL气体(标准状况)即氨气,所以原溶液中含n(NH4+)=0.448/22.4=0.02mol;
最后根据电荷守恒确定电解质溶液中的K+是否存在,以此解答该题。
![]() 溶液无色,不含
溶液无色,不含![]() ,故A错误;
,故A错误;
B.含有硫酸根离子,可生成硫酸银,故B错误;
C.根据电荷守恒,明显阳离子所带的正电量比阴离子所带的负电量少,则原溶液一定还有![]() ,不需要焰色反应,故C正确;
,不需要焰色反应,故C正确;
D.加入氯水,生成的盐酸可与碳酸根离子反应,实验![]() 不能够确定是否含有
不能够确定是否含有![]() ,故D错误。
,故D错误。
故选:C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】向四个相同容积的密闭容器中分别充入一定量的CO、H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g)。开始反应时,按正反应速率由大到小的顺序排列,正确的是
CH3OH(g)。开始反应时,按正反应速率由大到小的顺序排列,正确的是
①在500℃时,5 mol CO和10 mol H2反应
②在500℃时,加入催化剂,10 mol H2与5 mol CO反应
③在450℃时,6 mol H2和3 mol CO反应
④在500℃时,6 mol H2和3 mol CO反应
⑤在450℃时,4 mol H2和2 mol CO反应
A.②①③④⑤B.②①④③⑤C.⑤②①③④D.②④⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用 H2C2O4 溶液和酸性 KMnO4 溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4 溶液 | 酸性 KMnO4 溶液 | 温度℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后 H2C2O4 转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移__________mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为 n(H2C2O4)∶n(KMnO4)≥______________。
(2)探究温度对化学反应速率影响的实验编号是____________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得 KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________mol·L-1·min-1。
(4)已知50℃时c(MnO4-)~反应时间 t 的变化曲线如图。若保持其他条件不变,请在坐标图中,画出 25℃时c(MnO4-)~t的变化曲线示意图________。
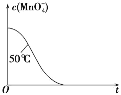
(5)高锰酸钾和草酸反应开始速率较慢,反应一会儿,速率突然加快,合理的原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液,经测定含有Al3+、Br-、SO42-,且各离子物质的量浓度相等(不考虑水电离出来的H+和OH-),则对该溶液的说法合理的是( )
A.可能含有![]() B.可能含有
B.可能含有![]() C.一定含有
C.一定含有![]() D.至少含有四种离子
D.至少含有四种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是
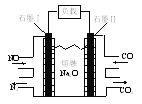
A.石墨Ⅰ电极上发生氧化反应
B.电池工作时Na向石墨Ⅱ电极处移动
C.石墨Ⅱ反应式:CO-2e-+O2-=CO2
D.电路中每通过6 mol电子,生成1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.如图表示某放热反应分别在有、无催化剂的反应过程
B.如图表示2NO2(g)![]() N2O4(g) ΔH<0的v逆 随时间变化曲线,t1时刻改变的条件是降低温度
N2O4(g) ΔH<0的v逆 随时间变化曲线,t1时刻改变的条件是降低温度
C.如图表示反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0的平衡常数K随压强的变化
2NH3(g) ΔH<0的平衡常数K随压强的变化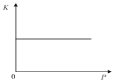
D.如图表示电解精炼铜过程中阳极质量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | a | 0.55 | 0 | 0.5 |
Ⅲ | T | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.反应Ⅲ的温度T<500℃
C.容器Ⅱ中起始时CO的物质的量为1.0 mol
D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80%]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中,可能大量存在下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现进行如下实验:
,现进行如下实验:
![]() 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
![]() 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
![]() 在第2份溶液中加入新制的氯水和
在第2份溶液中加入新制的氯水和![]() ,振荡后静置,下层溶液显橙红色。
,振荡后静置,下层溶液显橙红色。
则下列推断正确的是![]()
A.溶液中一定有![]() 、
、![]() 、
、![]() 、
、![]()
B.溶液中一定没有![]() 、
、![]() 、
、![]() 、
、![]()
C.不能确定溶液中是否有![]() 、
、![]() 、
、![]()
D.往第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小
B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大
D.充入一定量的氮气,n(H2)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com