
【题目】下列图示与对应的叙述相符的是
A.如图表示某放热反应分别在有、无催化剂的反应过程
B.如图表示2NO2(g)![]() N2O4(g) ΔH<0的v逆 随时间变化曲线,t1时刻改变的条件是降低温度
N2O4(g) ΔH<0的v逆 随时间变化曲线,t1时刻改变的条件是降低温度
C.如图表示反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0的平衡常数K随压强的变化
2NH3(g) ΔH<0的平衡常数K随压强的变化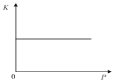
D.如图表示电解精炼铜过程中阳极质量随时间的变化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应A+aB![]() C+2D(a为化学计量数),其中B,C,D为气态物质。反应过程中,当其他条件不变时,C的体积百分含量()与温度(T)和压强(p)的关系如图1、2所示。下列不正确的是( )
C+2D(a为化学计量数),其中B,C,D为气态物质。反应过程中,当其他条件不变时,C的体积百分含量()与温度(T)和压强(p)的关系如图1、2所示。下列不正确的是( )
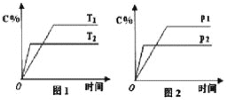
A. T2 >T1,P2 >P1
B. 该反应的正反应为放热反应
C. 若a=2,则A为液态或固态物质
D. 增加B的物质的量,该反应的ΔH绝对值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,可由MnSO4和NaClO3溶液反应制得,反应原理为: MnSO4+ NaClO3+ H2O![]() Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
A.NaClO3中Cl的化合价为+5
B.每生成8.7 g氧化产物,反应中转移的电子数约为0.2×6.02×1023
C.NaClO3的氧化性强于MnO2的氧化性
D.该反应右边方框内的产物是NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
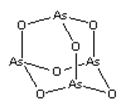
A.As2O3 分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:![]() 某无色溶液中只可能含有
某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分离子,进行下列实验:通过实验得出的结论正确的是
中的部分离子,进行下列实验:通过实验得出的结论正确的是![]()
实验编号 | 操作 | 现象 |
| 取10mL溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入过量的NaOH溶液并加热 | 产生448L气体 |
A.实验![]() 中若通入过量的
中若通入过量的![]() ,则先后氧化了
,则先后氧化了![]() 、
、![]()
B.上述3个实验不能确定是否一定含有![]() ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有
,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有![]()
C.判断溶液中是否含有钾离子,不需要通过焰色反应来检验
D.实验![]() 能够确定溶液中不含有
能够确定溶液中不含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
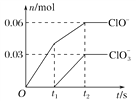
A. 反应中转移电子的物质的量是0.21 mol
B. ClO![]() 的生成可能是由于温度升高引起的
的生成可能是由于温度升高引起的
C. 标准状况下有3.36 L氯气参加反应
D. 苛性钾溶液中KOH的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
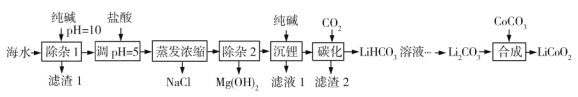
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
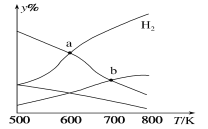
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com