
【题目】MnO2是一种重要的无机功能材料,可由MnSO4和NaClO3溶液反应制得,反应原理为: MnSO4+ NaClO3+ H2O![]() Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
A.NaClO3中Cl的化合价为+5
B.每生成8.7 g氧化产物,反应中转移的电子数约为0.2×6.02×1023
C.NaClO3的氧化性强于MnO2的氧化性
D.该反应右边方框内的产物是NaOH
科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是
A.  3﹣甲基﹣2﹣乙基戊烷
3﹣甲基﹣2﹣乙基戊烷
B. (CH3)3CCH2CH(C2H5)CH32,2﹣二甲基﹣4﹣乙基戊烷
C. ![]() 邻甲基苯酚
邻甲基苯酚
D. ![]() 2﹣甲基﹣3﹣戊炔
2﹣甲基﹣3﹣戊炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,c(HCN)+c(CN-)=0.1 mol·L-1的一组HCN和NaCN的混合溶液,溶液中 c(HCN)、c(CN-)与pH的关系如图所示。下列有关离子浓度关系叙述正确的是( )
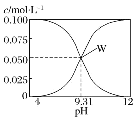
A.将 0.1 mol·L-1 的 HCN 溶液和 0.1 mol·L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+)
B.W 点表示溶液中:c(Na+)=c(HCN)+c(CN-)
C.pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1 mol·L-1+c(OH-)
D.将0.3 mol·L-1 HCN溶液和0.2 mol·L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=c(HCN)+3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)按系统命名法给下列有机物命名:
①(CH3)2CHCH(Cl)CH3:___。
②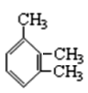 :___。
:___。
(2)羟基的电子式是:___。
(3)2-甲基-1-丁烯的键线式:___。
(4)相对分子质量最小的有机物空间构型是___。
(5)3-甲基戊烷的一氯代产物有___种(考虑立体异构)。
(6)高分子化合物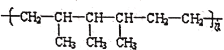 的单体分别是___。
的单体分别是___。
(7)写出下列有机反应的方程式:
①2-溴丙烷的水解反应:___。
②3-甲基-2-丁醇的催化氧化反应:___。
③实验室制乙烯:___。
④对苯二甲酸和乙二醇的缩聚反应:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用 H2C2O4 溶液和酸性 KMnO4 溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4 溶液 | 酸性 KMnO4 溶液 | 温度℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后 H2C2O4 转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移__________mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为 n(H2C2O4)∶n(KMnO4)≥______________。
(2)探究温度对化学反应速率影响的实验编号是____________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得 KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________mol·L-1·min-1。
(4)已知50℃时c(MnO4-)~反应时间 t 的变化曲线如图。若保持其他条件不变,请在坐标图中,画出 25℃时c(MnO4-)~t的变化曲线示意图________。
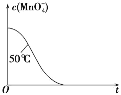
(5)高锰酸钾和草酸反应开始速率较慢,反应一会儿,速率突然加快,合理的原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
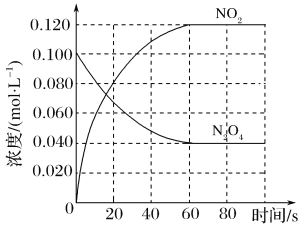
该反应ΔH______0(填“>”、“<”或“=”),在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。平衡常数K=________________(请书写单位)。在温度不变的情况下向平衡体系中再充入N2O4 0.01mol·L-1和NO20.03mol·L-1此时v(正)___________v(逆)(填“>”、“<”或“=”)。有利于提高反应N2O4(g) ![]() 2NO2(g)平衡转化率的条件是________(填标号)。
2NO2(g)平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在一定温度下,向a L密闭容器中加入1 molN2O4(g)发生如下反应:N2O4(g) ![]() 2NO2(g),不能说明该反应一定达平衡的是__________。
2NO2(g),不能说明该反应一定达平衡的是__________。
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1:2:2
D.单位时间内生成1 mol N2O4(g),同时生成2 mol NO2
E.混合气体的密度不随时间变化
F.混合气体的颜色不随时间变化
(3)在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是__________
A. 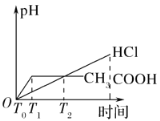 B.
B. 
C. 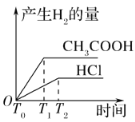 D.
D. 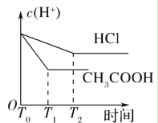
(4)25 ℃时,一元弱酸HA溶液Kal=4.3×10-4 ,一元弱酸HB溶液Ka2=5.6×10-4则酸性HA____________HB(填“>”、“<”或“=”)。
(5)常温下0.001mol·L-1的H2SO4溶液与0.004mol·L-1的NaOH溶液1:1体积比混合,混合后溶液的pH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液,经测定含有Al3+、Br-、SO42-,且各离子物质的量浓度相等(不考虑水电离出来的H+和OH-),则对该溶液的说法合理的是( )
A.可能含有![]() B.可能含有
B.可能含有![]() C.一定含有
C.一定含有![]() D.至少含有四种离子
D.至少含有四种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.如图表示某放热反应分别在有、无催化剂的反应过程
B.如图表示2NO2(g)![]() N2O4(g) ΔH<0的v逆 随时间变化曲线,t1时刻改变的条件是降低温度
N2O4(g) ΔH<0的v逆 随时间变化曲线,t1时刻改变的条件是降低温度
C.如图表示反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0的平衡常数K随压强的变化
2NH3(g) ΔH<0的平衡常数K随压强的变化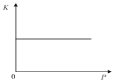
D.如图表示电解精炼铜过程中阳极质量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com