
【题目】实验室使用的浓盐酸的溶质质量分数一般为36.5%,密度为1.19g/cm3.
(1)求该浓盐酸的物质的量浓度为多少?
(2)若使用该盐酸配制250mL1.00mol/L盐酸,则需要该盐酸多少体积?
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ能量,根据如图中的能量图,回答下列问题:
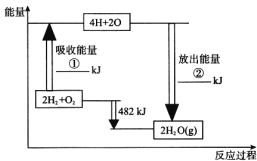
(1)分别写出①②的数值:
①__________;②__________。
(2)生成H2(Xg)中的1 mol H—O键放出__________kJ的能量。
(3)已知:H2O(l)![]() H2O(g)△H=+44 kJ mol1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:___________________________________。
H2O(g)△H=+44 kJ mol1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)

请回答以下问题:
(1)B是____________,F是____________,G是____________。(填化学式)
(2)C物质在日常生活中可作____________剂。
(3)写出反应①的化学方程式:____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业的核心反应:N2(g)+3H2(g)![]() 2NH3(g)的反应过程中能量变化如图所示,回答下列问题:
2NH3(g)的反应过程中能量变化如图所示,回答下列问题:

(1)ΔH=______;在反应体系中加入催化剂,反应速率增大,E2的变化是______(填“增大”“减小”或“不变”);△H (填“增大”“减小”或“不变”)。
(2)在500℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______(填“<”“>”或“=”)46.2 kJ,理由__________________________________。
(3)已知在25℃、101 kPa时,14克CO气体完全燃烧放出热量为Q kJ。
请写出CO燃烧热的热化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变ΔH=ΔH1+ΔH2。满足上述条件的X、Y可能是

①C、CO ②S、SO3 ③Na、Na2O
④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)小丁同学在某次实验中大约需要0.20mol/L的氢氧化钠溶液850 mL,配制时涉及到如下操作:
①轻轻振荡容量瓶(振荡时不能将溶液溢出刻度线外),使溶液充分混合;
②用天平称量纯净的氢氧化钠固体_____________g;
③待烧杯中的溶液冷却后沿玻璃棒小心地注入__________(填容量瓶规格)容量瓶中;
④将容量瓶用瓶塞盖好,反复上下颠倒、摇匀;
⑤将配制好的溶液倒入干燥、洁净的试剂瓶中,贴好标签备用;
⑥将称量好的氢氧化钠固体放入烧杯中,加入适量的蒸馏水使固体完全溶解;
⑦改用___________滴加蒸馏水至溶液的凹液面正好与刻度线相切
⑧用蒸馏水洗涤烧杯内壁2~3次,将每次洗涤后的溶液也都注入容量瓶中
⑨向容量瓶中注入蒸馏水,直到容量瓶中的液面接近容量瓶刻度处1cm~2cm处
请协助小丁同学先完成操作中的空余部分,再在下列选项中选择正确的操作顺序。正确的操作顺序是(_______)。
A.②⑥③④①⑦⑧⑨⑤ B.②⑥③⑧①⑨⑦④⑤
C.②③①④⑥⑦⑧⑨⑤ D.②③①⑥⑦⑧⑨④⑤
(2)下列操作会使所配溶液物质的量浓度偏低的是__________________________。
A.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度
B.定容时向容量瓶中加蒸馏水,超过刻度线,再吸出少许
C.小烧杯、玻璃棒没有洗涤 D.观察容量瓶刻度时仰视
E.所用容量瓶中,已有少量蒸馏水 G.称量时已观察到NaOH吸水
F.在未降至室温时,立即将溶液转移至容量瓶定容
(3)因为NaOH具有腐蚀性,所以称量时,需注意选择用___________盛装NaOH固体;
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol·L-1的MgCl2溶液中含Cl-的数目为0.2NA
B. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
C. 标准状况下,11.2 L CCl4中含有的分子数为2NA
D. 20 mL 2 mol·L-1 H2O2溶液中,溶质所含电子数为7.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com