
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
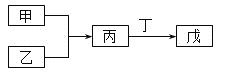
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
【答案】D
【解析】
A.甲为单质,若甲可以与NaOH溶液反应放出![]() ,则甲为Al或Si,所以丙可能是氧化铝,也可能是二氧化硅,不一定是两性氧化物,故A错误;
,则甲为Al或Si,所以丙可能是氧化铝,也可能是二氧化硅,不一定是两性氧化物,故A错误;
B.若甲为短周期中最活泼的金属,且戊为碱,则甲为Na,乙为氧气,所以丙可以为氧化钠或过氧化钠,当丙为氧化钠时,丙生成戊不是氧化还原反应,故B错误;
C.丙、丁混合产生白烟,则丙、丁可为HCl和![]() 或
或![]() 和
和![]() 等,甲、乙均为单质,则乙可能是氯气或氢气或氮气,都不具有漂白性,故C错误;
等,甲、乙均为单质,则乙可能是氯气或氢气或氮气,都不具有漂白性,故C错误;
D.若甲、丙、戊含有同一种元素,当甲为S,乙为氧气,丙为二氧化硫,丁为HClO等具有强氧化性的物质,戊为硫酸,则含S元素的化合价由低到高的顺序为甲![]() 丙
丙![]() 戊,故D正确;
戊,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】a曲线表示一定条件下X(g)+Y(g)![]() 2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 ( )
2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 ( )
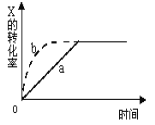
A.加入催化剂B.增大Y的浓度C.降低温度D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱工业是基本无机化工之一。完成下列填空:
(1)常温下向纯碱溶液中滴加酚酞试液,溶液变红,原因是___(用离子方程式表示);继续滴加足量氯化钡溶液,可以看到__。
(2)最早的勒布朗法制碱涉及如下反应:Na2SO4+2C+CaCO3![]() Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
(3)索尔维法(氨碱法)是工业生产纯碱的主要方法,其主要原理可以表示为:NaCl(饱和)+H2O+CO2+NH3=NaHCO3↓+NH4Cl。该反应涉及的各物质中,属于弱电解质的是___。综合平衡理论解释通入CO2和NH3后为何会有NaHCO3析出___。
(4)侯德榜对索尔维法进行了改进,利用平衡移动原理从析出NaHCO3后的母液中提取NH4Cl产品,所需的物质有___(填化学式)。
(5)纯碱厂在生产过程中要时刻关注设备的腐蚀情况。输送饱和食盐水的铸铁管道受到腐蚀时,正极的电极反应方程式为:___。为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,该方法称为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,正确的方法是( )
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2晶体
MgCl2晶体![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__。
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是__(填字母)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=__(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是__(填字母)。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是__(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是__(填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,__(填离子符号)先沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子材料M的结构简式为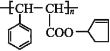 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
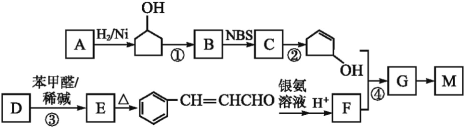
已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
请回答以下问题:
(1)A的结构简式为____,B的名称为____,F中所含官能团的名称是__________。
(2)①和③的反应类型分别是____、____;反应②的反应条件为_____________。
(3)反应④的化学方程式为_____________________________________________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有___种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某吸水材料与聚酯纤维都是重要的化工原料。它们的合成路线如图所示:
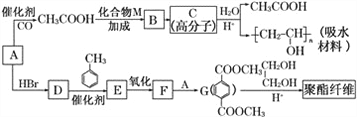
已知:①A由C、H、O三种元素组成,相对分子质量为32。
②RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
请回答下列问题:
(1) A的结构简式是____________________。
(2)B中的官能团名称是______________________。
(3)D→E的反应类型是______________。
(4)①乙酸与化合物M反应的化学方程式是_________________________________
②G→聚酯纤维的化学方程式是______________。
(5) E的名称是___________。
(6) G的同分异构体有多种,满足下列条件的共有_____种。
①苯环上只有两个取代基;
② 1 mol该物质与足量的NaHCO3溶液反应生成2 mol CO2。
(7) 写出由![]() 合成
合成![]() 的流程图(注明反应条件)________。
的流程图(注明反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成化合物![]() 和
和![]() ,且
,且![]() 是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
![]() 的离子结构示意图为 ______ ,B、C、D、E与A形成的化合物中稳定性最强的是 ______
的离子结构示意图为 ______ ,B、C、D、E与A形成的化合物中稳定性最强的是 ______ ![]() 填化学式
填化学式![]() .
.
![]() 在加热和Cu作催化剂时,化合物
在加热和Cu作催化剂时,化合物![]() 与
与![]() 反应生成其中一种产物是
反应生成其中一种产物是![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
![]() 五种元素中,含同一元素的各类物质能实现下列转化的有
五种元素中,含同一元素的各类物质能实现下列转化的有![]() 图
图![]() ______
______ ![]() 填元素符号
填元素符号![]()
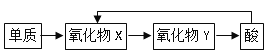
![]() 图所示是一种酸性燃料电池
图所示是一种酸性燃料电池![]() 检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应为 ______
检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应为 ______ ![]() 出口处的物质 ______ .
出口处的物质 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
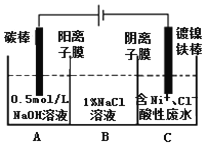
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com