
【题目】纯碱工业是基本无机化工之一。完成下列填空:
(1)常温下向纯碱溶液中滴加酚酞试液,溶液变红,原因是___(用离子方程式表示);继续滴加足量氯化钡溶液,可以看到__。
(2)最早的勒布朗法制碱涉及如下反应:Na2SO4+2C+CaCO3![]() Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
(3)索尔维法(氨碱法)是工业生产纯碱的主要方法,其主要原理可以表示为:NaCl(饱和)+H2O+CO2+NH3=NaHCO3↓+NH4Cl。该反应涉及的各物质中,属于弱电解质的是___。综合平衡理论解释通入CO2和NH3后为何会有NaHCO3析出___。
(4)侯德榜对索尔维法进行了改进,利用平衡移动原理从析出NaHCO3后的母液中提取NH4Cl产品,所需的物质有___(填化学式)。
(5)纯碱厂在生产过程中要时刻关注设备的腐蚀情况。输送饱和食盐水的铸铁管道受到腐蚀时,正极的电极反应方程式为:___。为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,该方法称为___。
【答案】CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 产生白色沉淀,溶液红色变浅直至变为无色 Na2SO4中+6价S元素 56 H2O 通入CO2和NH3后,溶液中HCO
+OH- 产生白色沉淀,溶液红色变浅直至变为无色 Na2SO4中+6价S元素 56 H2O 通入CO2和NH3后,溶液中HCO![]() 物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)
物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)![]() Na+(aq)+HCO
Na+(aq)+HCO![]() (aq)平衡逆向移动,析出NaHCO3晶体 NH3、NaCl O2+2H2O+4e-═4OH- 牺牲阳极的阴极保护法
(aq)平衡逆向移动,析出NaHCO3晶体 NH3、NaCl O2+2H2O+4e-═4OH- 牺牲阳极的阴极保护法
【解析】
(1)加酚酞变红,说明溶液显碱性,原因是碳酸根离子水解,水解的离子方程式为:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。加足量氯化钡,Ba2+和CO
+OH-。加足量氯化钡,Ba2+和CO![]() 反应生成BaCO3沉淀,碳酸根离子水解平衡向左移动,OH-浓度减小,红色变浅直至变为无色,故答案为:CO
反应生成BaCO3沉淀,碳酸根离子水解平衡向左移动,OH-浓度减小,红色变浅直至变为无色,故答案为:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-;产生白色沉淀,溶液红色变浅直至变为无色;
+OH-;产生白色沉淀,溶液红色变浅直至变为无色;
(2)Na2SO4中+6价的S变为CaS中-2价的S,被还原,1mol Na2SO4参与反应转移8mol电子。6.02×1024个电子的物质的量=10mol,则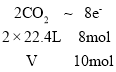 ,解得V=56L,故答案为:Na2SO4中+6价的S元素;56;
,解得V=56L,故答案为:Na2SO4中+6价的S元素;56;
(3)NaCl、NaHCO3、NH4Cl是强电解质,H2O是弱电解质,CO2、NH3是非电解质。通入CO2和NH3后,溶液中HCO![]() 物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)
物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)![]() Na+(aq)+HCO
Na+(aq)+HCO![]() (aq)平衡逆向移动,析出NaHCO3晶体,故答案为:H2O;通入CO2和NH3后,溶液中HCO
(aq)平衡逆向移动,析出NaHCO3晶体,故答案为:H2O;通入CO2和NH3后,溶液中HCO![]() 物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)
物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)![]() Na+(aq)+HCO
Na+(aq)+HCO![]() (aq)平衡逆向移动,析出NaHCO3晶体;
(aq)平衡逆向移动,析出NaHCO3晶体;
(4)由NH4Cl(s)![]() NH4+(aq)+Cl-(aq)可知,要提取NH4Cl产品,需增大NH4+和Cl-的浓度,所需物质为NH3和NaCl,故答案为:NH3、NaCl;
NH4+(aq)+Cl-(aq)可知,要提取NH4Cl产品,需增大NH4+和Cl-的浓度,所需物质为NH3和NaCl,故答案为:NH3、NaCl;
(5)NaCl溶液显中性,铸铁发生吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-,为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,Al、Zn都比Fe活泼,作负极,Fe作正极被保护,该方法称为牺牲阳极的阴极保护法,故答案为:O2+2H2O+4e-=4OH-;牺牲阳极的阴极保护法。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
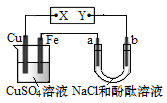
A.X是负极,Y是正极
B.CuSO4溶液的pH减小
C.a极产生的气体能使湿润的红色石蕊试纸先变红后褪色
D.若电路中转移了0.02 mol e-,Fe电极增重0.64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为_______________________;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为____________________。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
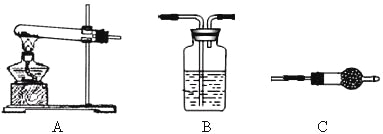
(1)各装置连接顺序为__________________________。
(2)能证明生成物中有CuCO3的实验现象是__________________。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
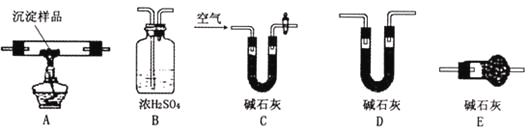

(1)装置C中碱石灰的作用是__________________,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是____________________________
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活、生产、环境、资源利用等息息相关。回答下列问题:
(1)氯化铁可用于净水,写出其溶于水的电离方程式:________;在氯化铁溶液中加入铁粉,发生反应的离子方程式是___________;在氯化铁的水溶液中逐滴加入氢氧化钠溶液,可观察到的现象是__________。
(2)漂白粉常用作棉、麻、纸张的漂白剂,还可用作游泳池及环境消毒剂。漂白粉的有效成分为_________,写出漂白粉在空气中失效的有关化学方程式:_________、________。
(3)pH小于5.6的天然降水称为酸雨,引起酸雨的主要物质是SO2和_________。燃煤脱硫可有效减少酸雨的形成,燃煤脱硫除用石灰法外,也可以向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为MgSO4,写出该反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
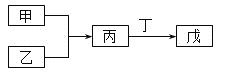
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
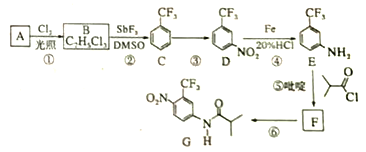
回答下列问题:
(1)A的结构简式为_______________。C的化学名称是________________________。
(2)③的反应试剂和反应条件分别是______________________,该反应的类型是___________。
(3)⑤的反应方程式为_____________________________________________。
吡啶是一种有机碱,其作用是______________________________。
(4)G的分子式为______________________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则Ⅱ可能的结构有_________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
)制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com