
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成化合物![]() 和
和![]() ,且
,且![]() 是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
![]() 的离子结构示意图为 ______ ,B、C、D、E与A形成的化合物中稳定性最强的是 ______
的离子结构示意图为 ______ ,B、C、D、E与A形成的化合物中稳定性最强的是 ______ ![]() 填化学式
填化学式![]() .
.
![]() 在加热和Cu作催化剂时,化合物
在加热和Cu作催化剂时,化合物![]() 与
与![]() 反应生成其中一种产物是
反应生成其中一种产物是![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
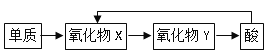
![]() 五种元素中,含同一元素的各类物质能实现下列转化的有
五种元素中,含同一元素的各类物质能实现下列转化的有![]() 图
图![]() ______
______ ![]() 填元素符号
填元素符号![]()
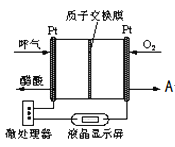
![]() 图所示是一种酸性燃料电池
图所示是一种酸性燃料电池![]() 检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应为 ______
检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应为 ______ ![]() 出口处的物质 ______ .
出口处的物质 ______ .
【答案】![]()
![]() 2CH3CH2OH +O2
2CH3CH2OH +O2![]() 2CH3CHO +2H2O N、S
2CH3CHO +2H2O N、S ![]()
![]()
【解析】
短周期元素中主族序数、周期数、原子序数均相同的是H,则A为H元素;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料,非金属单质常用作电极的是碳,则B为C元素;D和A可形成化合物![]() 和
和![]() ,且
,且![]() 是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S,据此进行解答。
是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S,据此进行解答。
短周期元素中主族序数、周期数、原子序数均相同的是H,则A为H元素;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料,非金属单质常用作电极的是碳,则B为C元素;D和A可形成化合物![]() 和
和![]() ,且
,且![]() 是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S;
是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S;
![]() 为S元素,硫离子有三个电子层,电子数依次为2、8、8,离子结构示意图为
为S元素,硫离子有三个电子层,电子数依次为2、8、8,离子结构示意图为![]() ,非金属性越强,对应氢化物的稳定性越强,C、N、O、S中非金属性O最强,稳定性最强的为
,非金属性越强,对应氢化物的稳定性越强,C、N、O、S中非金属性O最强,稳定性最强的为![]() ;
;
![]() 与
与![]() 分别为
分别为![]() 、
、![]() ,在铜作催化剂条件下加热,乙醇与氧气反应生成乙醛,反应的化学方程式为:
,在铜作催化剂条件下加热,乙醇与氧气反应生成乙醛,反应的化学方程式为:![]() ;
;
![]() 根据转化关系可知,单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有变价,5种元素中满足条件的元素为:N、S;
根据转化关系可知,单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有变价,5种元素中满足条件的元素为:N、S;
![]() 为
为![]() ,根据图可知,该原电池的燃料为乙醇和氧气,生成物乙酸和水,电解质为酸性溶液,原电池负极失去电子发生了氧化反应,所以负极反应为乙醇失去电子生成乙酸,电极反应为:
,根据图可知,该原电池的燃料为乙醇和氧气,生成物乙酸和水,电解质为酸性溶液,原电池负极失去电子发生了氧化反应,所以负极反应为乙醇失去电子生成乙酸,电极反应为:![]() ,正极在酸性条件下氧气得到电子发生了还原反应:
,正极在酸性条件下氧气得到电子发生了还原反应:![]() ,所以A处为
,所以A处为![]() 。
。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为_______________________;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为____________________。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
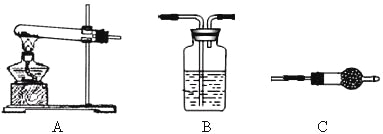
(1)各装置连接顺序为__________________________。
(2)能证明生成物中有CuCO3的实验现象是__________________。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
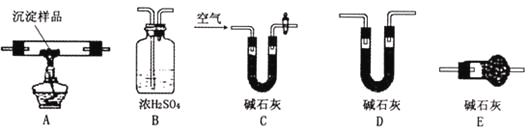

(1)装置C中碱石灰的作用是__________________,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是____________________________
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
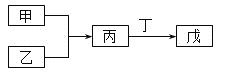
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:
①KCl ②CH4 ③NH4NO3 ④I2 ⑤Na2O2 ⑥HClO4 ⑦N2 ⑧CO ⑨SO2 ⑩金刚石 CH3CH2OH MgO MgCl2 KOH HCl Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
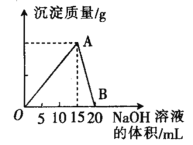
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3 溶液的物质的量浓度是______________。
(5)写出A~B段反应的离子方程式____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
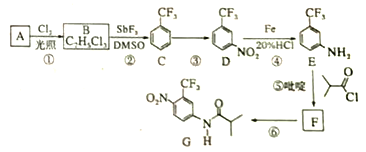
回答下列问题:
(1)A的结构简式为_______________。C的化学名称是________________________。
(2)③的反应试剂和反应条件分别是______________________,该反应的类型是___________。
(3)⑤的反应方程式为_____________________________________________。
吡啶是一种有机碱,其作用是______________________________。
(4)G的分子式为______________________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则Ⅱ可能的结构有_________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
)制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g)的影响如图所示,下列说法正确的是( )
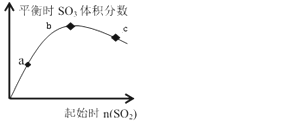
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com